题目内容
15.25℃、101kPa下,4g CH4完全燃烧生成CO2和液态H2O时,放出222.5kJ的热量,则下列热化学方程式中正确的是( )| A. | CH4(g)+2O2(g)=CO2(g)+4H2O(g)△H=-890 kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890 kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-445 kJ/mol | |
| D. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ/mol |
分析 4g CH4完全燃烧生成液态水和CO2气体,放出222.5kJ的热量,则1mol即16g CH4完全燃烧生成液态水和CO2气体,4×222.5kJ=890kJ由此分析解答.
解答 解:4g CH4完全燃烧生成液态水和CO2气体,放出222.5kJ的热量,则1mol即16g CH4完全燃烧生成液态水和CO2气体,4×222.5kJ=890kJ,
则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol,故D正确;
故选D.
点评 本题主要考查了热化学方程式的书写,注意热化学方程式的意义是解题的关键,题目难度不大,明确物质的量与反应热的关系是解题的关键.

练习册系列答案
相关题目
5.下列物质各3g,在氧气中完全燃烧,于150℃时将产物通过足量的Na2O2固体后,固 体增重大于3g的是( )
| A. | HCOOH | B. | CH3COOH | C. | C2H5OH | D. | C6H12O6 |
6.下列离子方程式,书写正确的是( )
| A. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag↓ | |
| D. | 盐酸跟氢氧化镁反应:H++OH-═H2O |
10.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
| A. | 35Cl原子所含质子数为18 | |
| B. | 1mol的1H35Cl分子所含中子数为18个 | |
| C. | 7g的35Cl2气体的体积为2.24L | |
| D. | 35Cl2气体的摩尔质量为70g/mol |
5.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H>0.现将1molA和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )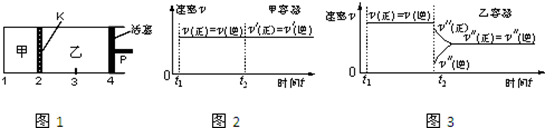

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
12.在一定条件下,向5L密闭容器中充入2molA气体和1mol B气体,发生可逆反应:2A(g)+B(g)?2C(g),达到平衡时容器内B的浓度为0.1mol/L,则B的转化率为( )
| A. | 67% | B. | 50% | C. | 25% | D. | 10% |
9.已知AgCl在水中有以下溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq).将AgCl分别投入下列溶液中:
①40mL 0.03mol/L的盐酸;
②50mL 0.03mol/L的硝酸银溶液;?
③30mL 0.02mol/L的氯化钙溶液;
④10mL蒸馏水.
AgCl在四种溶液中的溶解度顺序为( )
①40mL 0.03mol/L的盐酸;
②50mL 0.03mol/L的硝酸银溶液;?
③30mL 0.02mol/L的氯化钙溶液;
④10mL蒸馏水.
AgCl在四种溶液中的溶解度顺序为( )
| A. | ?④>①=②>③ | B. | ?④>①>②=③ | C. | ?④=①>②>③ | D. | ?①=②>④>③ |
10.当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯中不可能出现的情况是( )
| A. | 溶液中有Fe2+和Cu2+ | B. | 溶液中只有Fe2+ | ||
| C. | 有铜粉无铁粉 | D. | 有铁粉无铜粉 |