题目内容
7.铝铁合金在微电机中有广泛应用,某兴趣小组为利用废弃的铝铁合金设计了如下实验流程制备聚合硫酸铁和明矾: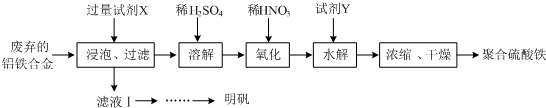
(1)聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n.
①聚合硫酸铁可用于净水的原理是聚合硫酸铁具有吸附作用.
②有人认为上述流程中的“氧化”设计存在缺陷,请提出改进意见:将稀HNO3改为H2O2(或O2、O3等);浓缩时向其中加入一定量的乙醇,加入乙醇的目的是降低聚合硫酸铁的溶解度,以便析出,所得产物易于干燥.
③加入试剂Y的目的是调节pH,所加试剂Y为Fe2O3;溶液的pH对[Fe2(OH)x(SO4)y]n 中x的值有较大影响(如图1所示),试分析pH过小(pH<3)导致聚合硫酸铁中x的值减小的原因:pH过小,会抑制Fe3+的水解.

(2)明矾是一种常见铝钾硫酸盐.
①为充分利用原料,试剂X应为KOH.
②请结合图2所示的明矾溶解度曲线,补充完整由滤液Ⅰ制备明矾晶体的实验步骤(可选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):向滤液Ⅰ中加入足量的含铝废铁屑至不再有气泡产生,过滤,向所得滤液中加入稀硫酸,生成白色沉淀,继续滴加稀硫酸至生成的沉淀溶解.将溶液蒸发浓缩、冷却结晶、过滤、并用酒精洗涤、干燥,最终得到明矾晶体.
分析 由流程可知,废弃的铝铁合金加入氢氧化钾溶液浸泡反应铝反应得到偏铝酸钾溶液,过滤,滤液经一系列操作反应生成硫酸铝钾,滤渣中加入稀硫酸和铁反应生成硫酸亚铁,加入稀硝酸氧化为硫酸铁,加入试剂Y调节溶液PH,但不能引入新的杂质,加入氧化铁和酸反应来调节溶液PH,酸性越强,对铁离子水解程度抑制越大,生成氢氧化铁少,得到溶液通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到聚合硫酸铁.
(1)①聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,具有较大表面积能吸附悬浮杂质净水的作用;
②流程中氧化过程是加入的稀硝酸,会引入杂质,可以改为绿色氧化剂如氧气、过氧化氢等,聚合硫酸铁微溶于乙醇,浓缩时向其中加入一定量的乙醇可以利于聚合硫酸铁析出,乙醇易挥发分析;
③加入氧化铁和酸反应来调节溶液PH,不引入新的杂质,图象分析可知PH<3,x值越小,是因为酸性条件下铁离子水解被抑制;
(2)①明矾是一种常见铝钾硫酸盐,所以为充分利用原料,试剂X应为氢氧化钾;
②明矾溶解度随温度升高溶解度增大,向滤液Ⅰ中加入足量的含铝废铁屑至不再有气泡产生,过滤除去过量的废铝铁屑,滤液这是铝和氢氧化钾溶液反应生成偏铝酸钾,加入稀硫酸生成白色沉淀氢氧化铝,继续加入稀硫酸沉淀溶解,所得溶液蒸发浓缩、冷却结晶,过滤,用酒精洗涤晶体,干燥得到明矾晶体.
解答 解(1)①聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,具有较大表面积能吸附悬浮杂质,有净水的作用,聚合硫酸铁可用于净水的原理是具有吸附作用,
故答案为:聚合硫酸铁具有吸附作用;
②上述流程中的“氧化”设计存在缺陷,流程中氧化过程是加入的稀硝酸,会引入杂质硝酸根离子,可以改为绿色氧化剂如氧气、过氧化氢等,氧气和过氧化氢被还原为水无污染,聚合硫酸铁微溶于乙醇,浓缩时向其中加入一定量的乙醇,可以降低聚合硫酸铁的溶解度利于聚合硫酸铁析出,乙醇易挥发得到晶体易于干燥;
故答案为:将稀HNO3改为H2O2(或O2、O3等);降低聚合硫酸铁的溶解度,以便析出,所得产物易于干燥;
③加入氧化铁和酸反应来调节溶液pH,所加试剂Y为Fe2O3,不引入新的杂质;图象分析可知PH<3,x值越小,是因为酸性条件下铁离子水解被抑制,分析pH过小(pH<3)导致聚合硫酸铁中x的值减小,
故答案为:Fe2O3;pH过小,会抑制Fe3+的水解;
(2)①明矾是一种常见铝钾硫酸盐,所以为充分利用原料,试剂X应为KOH,故答案为:KOH;
②明矾溶解度随温度升高溶解度增大,向滤液Ⅰ中加入足量的含铝废铁屑至不再有气泡产生,过滤除去过量的废铝铁屑,滤液中是铝和氢氧化钾溶液反应生成偏铝酸钾,加入稀硫酸生成白色沉淀氢氧化铝,继续加入稀硫酸沉淀溶解,所得溶液蒸发浓缩、冷却结晶,过滤,用酒精洗涤晶体,干燥得到明矾晶体,
故答案为:向所得滤液中加入稀硫酸,生成白色沉淀,继续滴加稀硫酸至生成的沉淀溶解;蒸发浓缩;冷却结晶.
点评 本题考查了物质的制备实验方案设计,为高考常见题型,侧重考查对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附. |
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1;
②C(s,石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1.则a=-28.5.
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是ad(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2:3
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a、b、c装置中能保护铁的是bc(填字母).
②若用d装置保护铁,X极的电极材料应是锌(填名称).
(5)25℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39.25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.215×1021.
| A. | H2SO4 | B. | CO2 | C. | NaOH | D. | HNO3 |
| A. | 二溴乙烷:Br2-CH2-CH2-Br | B. | 3,3,4-三甲基己烷: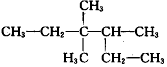 | ||
| C. | 3乙基1丁烯: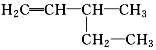 | D. | 2,2,3三甲基戊烷: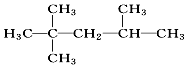 |

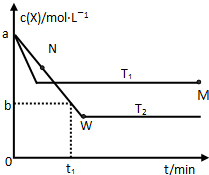 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.