题目内容
现有浓度为0.1mol/L的五种电解质溶液:
①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa;⑤NaOH.
已知:CO2+3H2O+2AlO3-═2Al(OH)3↓+CO32-
(1)上述五种溶液的pH由大到小的顺序为 .(填序号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是 .(填序号)
(3)在上述五种溶液中分别加入AlCl3溶液后,能产生无色气体的是 :(填序号)
①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa;⑤NaOH.
已知:CO2+3H2O+2AlO3-═2Al(OH)3↓+CO32-
(1)上述五种溶液的pH由大到小的顺序为
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是
(3)在上述五种溶液中分别加入AlCl3溶液后,能产生无色气体的是
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:盐类的水解专题
分析:(1)溶液中溶质浓度相同,氢氧化钠是强碱,电离产生氢氧根离子,pH最大,盐中阳离子相同,酸越弱,其盐的酸根水解程度越大,据此解答.
(2)根据是否存在平衡分析判断,不存在平衡的pH值变化大;
(3)碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳.
(2)根据是否存在平衡分析判断,不存在平衡的pH值变化大;
(3)碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳.
解答:
解:(1)①、②、③、④是盐,⑤是碱,浓度相同,碱的PH值最大,①、②、③、④四种盐的阳离子相同,其阴离子对应的酸越弱,酸根的水解程度越大,酸性:醋酸>碳酸>碳酸氢根>偏铝酸,浓度相同,酸根的水解程度越大,pH值越大,故pH为⑤③①②④,
故答案为:⑤③①②④;
(2)①②③④都存在水解平衡,当稀释时,盐的弱酸根又水解出部分离子进行补充;氢氧化钠是强碱,完全电离,不存在电离平衡,所以当稀释时,其pH变化最大;
故答案为:⑤;
(3)碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳,NaAlO2与氯化铝发生双水解反应生成氢氧化铝沉淀,CH3COONa与氯化铝不反应,NaOH与氯化铝反应生成氢氧化铝沉淀,故答案为:①②;
故答案为:⑤③①②④;
(2)①②③④都存在水解平衡,当稀释时,盐的弱酸根又水解出部分离子进行补充;氢氧化钠是强碱,完全电离,不存在电离平衡,所以当稀释时,其pH变化最大;
故答案为:⑤;
(3)碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳,NaAlO2与氯化铝发生双水解反应生成氢氧化铝沉淀,CH3COONa与氯化铝不反应,NaOH与氯化铝反应生成氢氧化铝沉淀,故答案为:①②;
点评:本题主要考查盐类水解等,难度中等,注意对盐类水解规律的理解,注意掌握常见彻底双水解反应.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
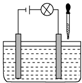 在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )| A、盐酸中逐滴加入食盐溶液 |
| B、醋酸中逐滴加入氢氧化钠溶液 |
| C、饱和石灰水中不断通入CO2 |
| D、醋酸中逐滴加入氨水 |
下列离子方程式中正确的是( )
| A、H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| B、碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+OH-═CO32-+H2O |
| C、常温下,将铜片加入稀硝酸中:Cu+2H+═Cu2++2H2↑ |
| D、氧化亚铁与稀硝酸反应:FeO+2H+═Fe2++H2O |

 ,每个COCl2分子内含有
,每个COCl2分子内含有 (1)HCNO是一种弱酸,它的酸性类似于醋酸,在水中微弱地电离出H+和CNO-.
(1)HCNO是一种弱酸,它的酸性类似于醋酸,在水中微弱地电离出H+和CNO-.