题目内容
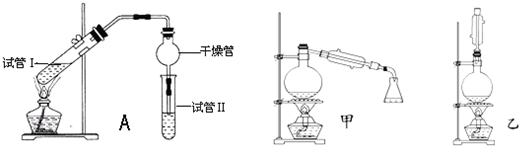
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应.
(1)甲同学设计的实验 (填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是 (填字母).
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中可能含有的一种杂质气体是 ,它与溴水发生反应的化学方程式是 在验证过程中该杂质必须全部除去.
(3)为了验证乙烯与浪水的反应是加成反应而不是取代反应.还可采取的方法是 .
(1)甲同学设计的实验
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中可能含有的一种杂质气体是
(3)为了验证乙烯与浪水的反应是加成反应而不是取代反应.还可采取的方法是
考点:乙醇的消去反应,乙烯的化学性质
专题:实验设计题
分析:用此法得到的乙烯内可能含有SO2气体,因SO2能将溴水还原而使之褪色,故溴水褪色不能证明是乙烯与溴水发生了加成反应;乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性.
解答:
解:(1)用此法得到的乙烯内可能含有SO2气体,因SO2能将溴水还原而使之褪色,方程式为:SO2+Br2+2H2O═2HBr+H2SO4,溴水褪色不能证明是乙烯与溴水发生了加成反应,
故答案为:不能;AC;
(2)SO2具有较强的还原性,根据元素守恒和还原性推断,气体只能是SO2,它与溴水发生反应的化学方程式是SO2+Br2+2H2O═2HBr+H2SO4,
故答案为:SO2;SO2+Br2+2H2O═2HBr+H2SO4;
(3)乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性,所以检验方法为:向反应后的溶液中滴加石蕊试液,溶液不变红,说明该反应为加成反应而非取代反应,
故答案为:向反应后的溶液中滴加石蕊试液,溶液不变红,说明该反应为加成反应而非取代反应.
故答案为:不能;AC;
(2)SO2具有较强的还原性,根据元素守恒和还原性推断,气体只能是SO2,它与溴水发生反应的化学方程式是SO2+Br2+2H2O═2HBr+H2SO4,
故答案为:SO2;SO2+Br2+2H2O═2HBr+H2SO4;
(3)乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性,所以检验方法为:向反应后的溶液中滴加石蕊试液,溶液不变红,说明该反应为加成反应而非取代反应,
故答案为:向反应后的溶液中滴加石蕊试液,溶液不变红,说明该反应为加成反应而非取代反应.
点评:本题主要考查乙烯的制备和性质实验,难度不大,本题中注意乙烯的除杂和性质实验,注意与溴水反应的性质.

练习册系列答案
相关题目
日常生活中常用到“加碘食盐”“含氟牙膏”等商品,这里的碘和氟应理解为( )
| A、单质 | B、分子 | C、元素 | D、氧化物 |
下列各组物质的溶液,不另加试剂无法一一鉴别的是( )
| A、NaOH HCl CuSO4 MgSO4 |
| B、Na2CO3 K2SO4 BaCl2 HCl |
| C、KNO3 HCl CaCl2 NaOH |
| D、NH4NO3 H2SO4 NaOH MgCl2 |
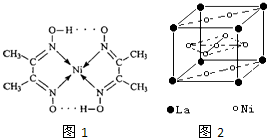 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有 (1)用它作为气体收集装置:若从a端进气可收集的有
(1)用它作为气体收集装置:若从a端进气可收集的有