题目内容
煤等化石燃料燃烧时产生的SO2会对大气造成污染.如果某火力发电厂每秒燃烧10kg煤,煤中硫元素的质量分数为1%.假设煤中的硫全部转化为SO2,试计算该发电厂每天产生的SO2的物质的量是多少?
考点:化学方程式的有关计算
专题:计算题
分析:根据煤中硫元素的质量分数为1%,计算10kg煤中硫元素的质量,由n=
计算硫原子的物质的量,根据硫元素守恒可知n(SO2)=n(S),进而计算每天产生的SO2的物质的量.
| m |
| M |
解答:
解:10kg煤中硫元素的质量为10000g×1%=100g,所以硫原子的物质的量为
=3.125mol,硫元素守恒可知n(SO2)=n(S)=3.125mol,故每天生成二氧化硫的物质的量=3.125mol×24×3600=2.7×105mol,
答:该发电厂每天产生的SO2的物质的量是2.7×105mol.
| 100g |
| 32g/mol |
答:该发电厂每天产生的SO2的物质的量是2.7×105mol.
点评:本题考查化学有关的计算,注意利用硫元素守恒进行计算,难度不大.

练习册系列答案
相关题目
Zn与稀HNO3反应生成硝酸锌,HNO3只有一种还原产物,锌与被还原的硝酸的物质的量比是4:1,请判断还原产物是( )
| A、NH4+ |
| B、NO |
| C、NO2 |
| D、N2O |
在一恒容密闭烧瓶中,25℃时存在平衡:2NO2(g)?N2O4(g)△H<0.将烧瓶置于100℃的水中,则下列物理量中不会改变的是( )
| A、颜色 |
| B、密度 |
| C、N2O4的浓度 |
| D、压强 |
背景材料:①2009年夏季,特氟隆不粘锅事件引起公众关注;②2009年冬季,诺贝尔化学奖授予研究蛋白质的科学家;③2011年初春,广东大部分地区进行了人工降雨;④2012年春末,某高速公路发生液氯运输车翻倒泄漏事故.下列相应说法正确的是( )
| A、特氟隆(聚四氟乙烯)的单体是氟利昂(CCl2F2) |
| B、蛋白质是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔现象 |
| C、附近人员应迅速远离液氯泄漏地点,并顺风方向疏散 |
| D、AgI和干冰都可用于人工降雨 |
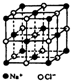 【化学--进修3:物质结构与性质】
【化学--进修3:物质结构与性质】