题目内容
(10分)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)当反应达到平衡时,N2和H2的浓度比是________;N2和H2的转化率比是________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量__________,密度__________。(此题两个空填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
(10分)答案 (1)1∶3(2分) ; 1∶1 (2分) ;
(2)变小 (1分);不变(1分) ;
(3)逆向(2分); (4)向左移动(1分); 小于(1分)。
【解析】
试题分析:(1)由于起始反应物的物质的量之比与化学计量数之比相等为1:3,所以当反应达到平衡时,N2和H2的浓度比是1:3;N2和H2的转化率比是1:1;(2) 由于ΔH<0,反应放热,升高平衡体系的温度(保持体积不变),平衡向逆反应方向移动,气体的物质的量增大,混合气体的平均相对分子质量减小,体积不变,质量守恒,所以密度不变;(3)当达到平衡时,充入氩气,并保持压强不变,则体积增大,平衡将向气体分子数增加的方向移动,即平衡将逆向移动;(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将向吸热的方向移动即向左移动。平衡移动过程中吸收热量,达到新平衡后,容器内温度小于原来的2倍。
考点:化学平衡移动


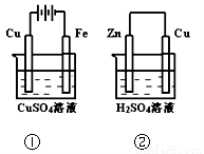
 下列叙述正确的是
下列叙述正确的是 个氢气分子所占的体积为22.4L
个氢气分子所占的体积为22.4L 与
与 离子总数为
离子总数为
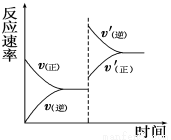
 pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,