题目内容
7.下列说法正确的是( )| A. | 镀铜铁制品镀层破损后,铁制品比破损前更容易生锈 | |
| B. | 标准状况下,22.4 L Cl2与足量NaOH溶液反应,转移电子数为2mol | |
| C. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
分析 A.原电池中负极加速被腐蚀,正极被保护;
B.Cl2与足量NaOH溶液反应生成NaCl和NaClO、水;
C.水的电离过程是一个吸热的过程;
D.Na2CO3溶液存在CO32-+H2O?HCO3-+OH-,溶液呈碱性,加入Ca(OH)2溶液,发生CO32-+Ca2+=CaCO3↓,以此解答该题.
解答 解:A.Cu、Fe和电解质溶液构成原电池,Fe易失电子作负极而加速被腐蚀,所以镀铜铁制品镀层破损后,铁制品比破损前更容易生锈,故A正确;
B.Cl2与足量NaOH溶液反应生成NaCl和NaClO、水,则1molCl2与足量NaOH溶液反应,转移电子数为1mol,故B错误;
C.水的电离过程是一个吸热的过程,水的离子积常数Kw随着温度的升高而增大,故C错误;
C.Na2CO3溶液存在CO32-+H2O?HCO3-+OH-,溶液呈碱性,加入Ca(OH)2溶液,发生CO32-+Ca2+=CaCO3↓,则c(OH-)增大,pH增大,c(CO32-)减小,水解程度减小,故D错误;
故选A.
点评 本题考查金属腐蚀与防护、弱电解质的电离以及盐类水解问题,为高频考点,侧重学生的分析能力的考查,注意把握盐类水解的影响因素,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO4-═2X2++5Z2+8H2O;
②2A2++B2═2A3++2B-;
③2B-+Z2═B2+2Z-.
由此推断下列说法错误的是( )
①16H++10Z-+2XO4-═2X2++5Z2+8H2O;
②2A2++B2═2A3++2B-;
③2B-+Z2═B2+2Z-.
由此推断下列说法错误的是( )
| A. | 反应Z2+2A2+═2A3++2Z-可以进行 | |
| B. | Z元素在反应③中被还原,在反应①中被氧化 | |
| C. | Z2可以置换出X2+溶液中的X | |
| D. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
2.已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用字母编号填写).
(2)常温下,0.1mol•L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填字母).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
E.c(H+)•c(CH3COO-)/c(CH3COOH)
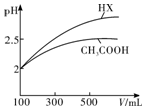
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(4)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+c(H+)+c(HCO3-);
②c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-).
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值).
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡 常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用字母编号填写).
(2)常温下,0.1mol•L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填字母).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
E.c(H+)•c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.

(4)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+c(H+)+c(HCO3-);
②c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-).
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值).
12.NA代表阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 在熔融状态下,1molNa2O2 完全电离出的离子数目为 3NA | |
| B. | 将 CO2 通过 Na2O2 使固体质量增加 mg,反应中转移的电子数 m NA/14 | |
| C. | 在标准状况下,22.4LCH4与 18 gH2O 所含有的电子数均为 10NA | |
| D. | 含 1mol Cl-的 NH4Cl 溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+的数目为NA. |
19.下列关于环境问题的说法不正确的是( )
| A. | 用甘蔗生产的乙醇燃料属于可再生能源,利用乙醇燃料不会产生温室气体 | |
| B. | 低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,可减少雾霾的发生 | |
| C. | 太阳能、风能和生物能源属于新能源 | |
| D. | 太阳能电池可将太阳能直接转化为电能 |
16.许多植物的花中含有色素,这些色素有的在酸性或碱性溶液中显示不同的颜色,故可作酸碱指示剂.现取三种花瓣,分别放在三个研钵中研磨,再依次加入酒精,搅拌,静置后得到花汁的酒精溶液.分别取少量上述所得的花汁的酒精溶液,用稀酸和稀碱液逐一检验,现象如下:
请回答:(1)以上所举的花中不能作酸碱指示剂的是万寿菊.
(2)经查资料得知,柑橘的近似pH为3.0~4.0.将大红花汁的酒精溶液滴入柑橘汁中,呈现的颜色应为橙色.
| 花的种类 | 花汁在酒精中的颜色 | 花汁在稀酸中的颜色 | 花汁在稀碱中的颜色 |
| 玫瑰 | 粉色 | 粉色 | 绿色 |
| 万寿菊 | 黄色 | 黄色 | 黄色 |
| 大红花 | 粉色 | 橙色 | 绿色 |
(2)经查资料得知,柑橘的近似pH为3.0~4.0.将大红花汁的酒精溶液滴入柑橘汁中,呈现的颜色应为橙色.