题目内容
1.雾霾天气多次肆虐我国中东部地区,给我们的生活带来诸多不便.其中,燃煤尾气和汽车尾气是造成空气污染的原因之一.(1)已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)=2CO2(g)△H2
2H2(g)+O2(g)=2H2O(g)△H3
则反应CO(g)+2H2(g)?CH3OH(g)的△H=△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3(用△H1、△H2和△H3表示)
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图1所示.据此判断:
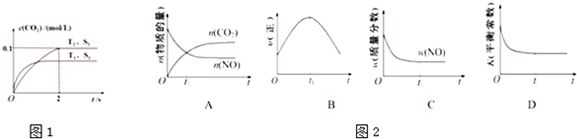
①在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s).
②该反应平衡常数表达式为:K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(CO)×{c}^{2}(NO)}$;升高温度时平衡常数K减小(选填:“增大”、“减小”或“不变”).
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是CD(填代号).
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①由图可知,T2温度平衡时,二氧化碳的浓度变化量为0.1mol/L,根据v=$\frac{△c}{△t}$计算v(CO2),再根据速率之比等于化学计量数之比计算v(N2);
②结合平衡常数的概念书写平衡表达式;根据先拐先平,温度高反应速率快,T1>T2,结合纵坐标二氧化碳浓度变化和平衡移动原理分析判断反应的热量变化,再判断温度升高时平衡移动的方向,推测平衡常数的变化;
③接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同;
④A.t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
B.到达平衡后正、逆速率相等,不再变化;
C.到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
D.到达平衡后各组分的含量不发生变化.
解答 解:(1)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
依据盖斯定律计算(①×2+②-③)×$\frac{1}{2}$得到,
反应CO(g)+2H2(g)═CH3OH(g)的△H=△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3
故答案为:△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3;
(2)①由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=$\frac{0.1mol/L}{2s}$=0.05mol/(L•s),速率之比等于化学计量数之比,故v(N2)=0.5v(CO2)=0.5×0.05mol/(L•s)=0.025mol/(L•s),
故答案为:0.025mol/(L•s);
②可逆反应2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)平衡常数表达式:K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(CO)×{c}^{2}(NO)}$;据图1,T1温度下反应速率最快,最先达到平衡,可知T1>T2,温度越高n(CO2)越小,正反应方向△H<0,则升高温度平衡逆向移动,平衡常数减小;
故答案为:$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(CO)×{c}^{2}(NO)}$;减小;
③接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为: ,
,
故答案为: ;
;
④A.t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故A错误;
B.到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故B错误;
C.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故C正确;
D.NO的质量分数为定值,t1时刻处于平衡状态,故D正确;
故答案为:CD.
点评 本题考查盖斯定律、化学平衡移动和物质的量计算,难度中等,其中热化学方程式书写,和焓变的计算,并能分析化学平衡中转化率曲线的变化,掌握基础是解题关键.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | 纤维素在人体内可水解为葡萄糖,故可用作人体的营养物质 | |
| B. | 补钙剂中常含有维生素D,其作用是为了促进钙的吸收 | |
| C. | 天然存在的动植物油脂,大多属于单甘油酯 | |
| D. | 蛋白质的盐析属于化学变化,可用于分离、提纯蛋白质 |
| A. | X的氧化物的熔点比Y的氧化物的熔点低 | |
| B. | X的氧化物和Z的最高价氧化物化合的产物中有共价键和离子键 | |
| C. | 简单离子半径:W>Z>Y>X | |
| D. | Z的氢化物比W的氢化物更稳定 |
| A. | Cl-离子的结构示意图: | |
| B. | 甲烷的球棍模型: | |
| C. | H2O2的电子式: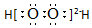 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3═Na++HCO3- |

| A. | NH4Cl和NaHCO3都是常用的化肥 | |
| B. | NH4Cl和HNO3受热时都易分解 | |
| C. | NH3和NO2在一定条件下可发生氧化还原反应 | |
| D. | 图中所涉及的盐类物质均为含氧酸盐 |
| A. | N2(g)+3H2(g)?2NH3(g)[在混合气体中φ(NH3)=33.3%] | |
| B. | CO(g)+H2O(g)?CO2(g)+H2(g)(在恒容容器中,容器内压强不再改变) | |
| C. | 2SO2(g)+O2(g)?2SO3(g)(在恒压条件下,总质量不再改变) | |
| D. | 2NO2(g)?2NO(g)+O2(g)(在恒容条件下,气体颜色不再改变) |
| A. |  | B. |  | C. |  | D. |  |
| A. | NaHA:c(Na+)>c(HA-)>c(OH-)>c(A2-)>c(H+) | B. | Na2A:c(Na+)=2[c(A2-)+c(HA-)+c(H2A)] | ||
| C. | Na2A:c(H+)+c(HA-)+2c(H2A)=c(OH-) | D. | H2A:c(H+)=c(HA-)+2c(A2-)+c(OH-) |
| A. | 通过电解熔融CD3可以制备C单质 | |
| B. | A和B可以形成气体,其分子一定为正四面体结构 | |
| C. | C的氢氧化物可以溶于D的最高价氧化物的水化物 | |
| D. | A2B2O4在水中可电离出阳离子和阴离子,所以A2B2O4中存在离子键 |