题目内容
 在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合如图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强,t表示时间).下列说法正确的是( )
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合如图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强,t表示时间).下列说法正确的是( )| A、此反应为吸热反应 |
| B、a+b<x |
| C、T1<T2 |
| D、P1<P2 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:由图可知,温度都为T1,压强P2先到达平衡,则压强P2>P1,压强越大,C的百分含量增大,说明增大压强平衡向正反应方向移动;压强都为P2,温度T1先到达平衡,故温度T1>T2,温度越高,平衡时C的含量越低,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,据此分析解答.
解答:
解:A.温度越高,平衡时C的含量越低,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,故A错误;
B.由图可知,温度都为T1,压强P2先到达平衡,则压强P2>P1,压强越大,C的百分含量增大,说明增大压强平衡向正反应方向移动,正反应是一个气体体积减小的反应,则有a+b>x,故B错误;
C.由图可知,压强都为P2,温度T1先到达平衡,反应速率较快,故温度T1>T2,故C错误;
D.由A中分析可知,压强P2>P1,故D正确,
故选D.
B.由图可知,温度都为T1,压强P2先到达平衡,则压强P2>P1,压强越大,C的百分含量增大,说明增大压强平衡向正反应方向移动,正反应是一个气体体积减小的反应,则有a+b>x,故B错误;
C.由图可知,压强都为P2,温度T1先到达平衡,反应速率较快,故温度T1>T2,故C错误;
D.由A中分析可知,压强P2>P1,故D正确,
故选D.
点评:本题考查化学平衡图象及影响因素,难度中等,注意采取控制变量法与“先拐先平数值大”原则分析解答.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
海水中有丰富的矿产、能源、药物、水产等化学化工资源,下图是某工厂对海水资源综合利用的示意图.下列有关说法正确的是( )


| A、海水中含有丰富的常量元素Mg和Br,以及微量元素I |
| B、流程②为:将MgCl2?6H2O在空气中受热分解制无水MgCl2 |
| C、在流程③④⑤中溴元素均被氧化 |
| D、流程①中欲除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,操作步骤为:依次加入Na2CO3溶液、NaOH溶液、BaCl2溶液,然后过滤,最后加入盐酸 |
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3③Al(OH)3 ④Al ⑤NaHSO4⑥AlCl3⑦NaAlO2.
①NaHCO3 ②Al2O3③Al(OH)3 ④Al ⑤NaHSO4⑥AlCl3⑦NaAlO2.
| A、①⑤ | B、②③④⑥⑦ |
| C、①②③④ | D、全部 |
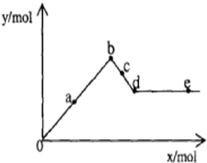 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )| A、d-e 时溶液中离子的物质的量:Ba2+可能等于AlO2- |
| B、b-c 时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d 时沉淀的物质的量:Al(OH)3一定小于BaSO4 |
| D、a-b 时沉淀的物质的量:Al(OH)3比BaSO4多 |
少量铁粉与100mL 0.01mol?L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的①加H2O ②加CH3COONa固体 ③改用10mL 0.1mol?L-1盐酸 ④滴入几滴硫酸铜溶液
⑤升高温度(不考虑盐酸挥发)( )
⑤升高温度(不考虑盐酸挥发)( )
| A、①② | B、②③ | C、③⑤ | D、④⑤ |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A、碳与二氧化碳在高温条件下反应 |
| B、Ba(OH)2?8H2O与NH4Cl的反应 |
| C、乙炔在O2中的燃烧 |
| D、氢氧化钠与稀盐酸反应 |