题目内容
(9分)
(1)3.6g H2O的物质的量是________,含有________mol H。
(2)在标准状况下,4g H2、11.2 L O2、1mol H2O中,所含分子数最多的是________,质量最大的是________。(填化学式)
(3)等质量的二氧化硫和三氧化硫,它们的物质的量之比为________,所含的硫原子数之比为________,所含的氧原子数之比为________。
(4)下列物质:①H2O ②石墨 ③NH4NO3 ④硫酸 ⑤ CH3COOH ⑥蔗糖 属于弱电解质的是 ;属于非电解质的是 (用编号填写)。
(1)0.2mol 0.4 (2)H2 H2O (3)5∶4 5∶4 5∶6(4)①⑤ ⑥
【解析】
试题分析:(1)3.6gH2O的物质的量为 ,含有0.4molH。
,含有0.4molH。
(2)标准状况下,4gH2的物质的量为 ,11.2LO2的物质的量为
,11.2LO2的物质的量为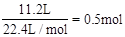 ,质量为16g,1molH2O的质量为18g。因此含分子数最多的是H2。质量最大的是H2O。
,质量为16g,1molH2O的质量为18g。因此含分子数最多的是H2。质量最大的是H2O。
(3)等质量的二氧化硫和三氧化硫,它们的物质的量之比为5∶4;所含的硫原子数之比为5∶4;所含的氧原子数之比为5∶6。
(4)弱电解质为:水、醋酸。非电解质为:蔗糖。
考点:物质的量与电解质综合
点评:电解质和非电解质都属于化合物,单质或混合物既不是电解质也不是非电解质。电解质主要包含酸碱盐和金属氧化物,非电解质主要包含有机物和大部分的非金属氧化物。强电解质包含强酸、强碱和大部分的盐类,弱电解质包含弱酸、弱碱和水。

 考前必练系列答案
考前必练系列答案(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| ΔH/( kJ·mol-1) | -283.0 | -285.8 | -726.5 |
请回答下列问题:①该条件下CH3OH(l)完全燃烧的热化学方程式为:__________________________。
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
② CH3OH(g)+O2(g)=CO2(g)+2H2(g) △H2
已知H2(g)+ O2(g)===H2O(g) △H = -241.8 kJ·mol-1
则反应②的△H2 = kJ·mol-1。
(3)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
|
化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
|
ΔH/( kJ·mol-1) |
-283.0 |
-285.8 |
-726.5 |
请回答下列问题:①该条件下CH3OH(l)完全燃烧的热化学方程式为:__________________________。
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
② CH3OH(g)+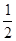 O2(g)=
CO2(g)+2H2(g) △H2
O2(g)=
CO2(g)+2H2(g) △H2
已知H2(g)+ 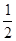 O2(g)===H2O(g)
△H = -241.8 kJ·mol-1
O2(g)===H2O(g)
△H = -241.8 kJ·mol-1
则反应②的△H2 = kJ·mol-1。
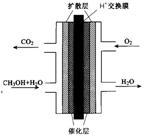
(3)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
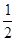 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2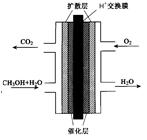

 2C(g)
2C(g)
