题目内容
向10mL0.1mol?L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( )
| A、x=10时,溶液中有NH4+、Al3+、SO42-,且c( NH4+)>c(Al3+) |
| B、x=15时,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-) |
| C、x=20时,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+) |
| D、x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)=c(Ba2+) |
考点:离子浓度大小的比较,离子方程式的有关计算
专题:
分析:10mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.001mol.溶液含有NH4+0.001mol、Al3+0.001mol、SO42-0.002mol;
x=10时,同时发生反应为:SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.003molOH-,即加入0.0015molBa(OH)2;
x=15时,加入的Ba2+为0.0015mol,Al3+沉淀完全,SO42-未完全沉淀,此时溶液含有硫酸铵;
x=20时,发生反应为:SO42-+Ba2+=BaSO4↓、NH4++OH-=NH3?H2O,SO42-完全沉淀,生成Al(OH)30.001mol,剩余0.001molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;
x=30时,溶液中的溶质为氢氧化钡、一水合氨,以此来解答.
x=10时,同时发生反应为:SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.003molOH-,即加入0.0015molBa(OH)2;
x=15时,加入的Ba2+为0.0015mol,Al3+沉淀完全,SO42-未完全沉淀,此时溶液含有硫酸铵;
x=20时,发生反应为:SO42-+Ba2+=BaSO4↓、NH4++OH-=NH3?H2O,SO42-完全沉淀,生成Al(OH)30.001mol,剩余0.001molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;
x=30时,溶液中的溶质为氢氧化钡、一水合氨,以此来解答.
解答:
解:A.当x=10时,10ml0.1mol/LNH4Al(SO4)2溶液中含有0.001molNH4+,0.001molAl3+,0.002molSO42-,同时发生反应为SO42-+Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓,c( NH4+)>c(Al3+),故A正确;
B.x=15时,加入的Ba2+为0.0015mol,Al3+沉淀完全,SO42-未完全沉淀,此时溶液含有硫酸铵,含有0.001molNH4+,0.0005molSO42-,且铵根离子水解,则c(NH4+)<2c(SO42-),故B正确;
C.x=20时,发生反应为:SO42-+Ba2+=BaSO4↓、NH4++OH-=NH3?H2O,SO42-完全沉淀,生成Al(OH)30.001mol,剩余0.001molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,故C错误;
D.当x=30时,10ml0.1mol/LNH4Al(SO4)2溶液中含有0.001molNH4+,0.001molAl3+,0.002molSO42-,30ml等浓度Ba(OH)2溶液有0.003molBa2+,6mmolOH-,混合后硫酸钡沉淀,剩余0.001molBa2+,OH-过量溶液中存在0.001moAlO2-,铵根离子和氢氧根离子反应生成一水合氨,氢氧根离子剩余0.001mol,一水合氨电离生成铵根离子和氢氧根离子,此时c(OH-)>(Ba2+),故D错误;
故选AB.
B.x=15时,加入的Ba2+为0.0015mol,Al3+沉淀完全,SO42-未完全沉淀,此时溶液含有硫酸铵,含有0.001molNH4+,0.0005molSO42-,且铵根离子水解,则c(NH4+)<2c(SO42-),故B正确;
C.x=20时,发生反应为:SO42-+Ba2+=BaSO4↓、NH4++OH-=NH3?H2O,SO42-完全沉淀,生成Al(OH)30.001mol,剩余0.001molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,故C错误;
D.当x=30时,10ml0.1mol/LNH4Al(SO4)2溶液中含有0.001molNH4+,0.001molAl3+,0.002molSO42-,30ml等浓度Ba(OH)2溶液有0.003molBa2+,6mmolOH-,混合后硫酸钡沉淀,剩余0.001molBa2+,OH-过量溶液中存在0.001moAlO2-,铵根离子和氢氧根离子反应生成一水合氨,氢氧根离子剩余0.001mol,一水合氨电离生成铵根离子和氢氧根离子,此时c(OH-)>(Ba2+),故D错误;
故选AB.
点评:本题考查离子反应的有关混合计算及离子浓度大小的比较,为高频考点,根据发生的反应及反应先后顺序、各物质的物质的量关系是解答的关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于电离平衡常数(K)的说法正确的是( )
| A、不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| B、电离平衡常数(K)越小,表示弱电解质电离能力越弱 |
| C、多元弱酸各步电离平衡常数相互关系为:K1<K2<K3 |
| D、CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 |
某研究性小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定只有是Fe,因为加热温度不同,受热不均时会含有少量的Fe3O4为探究X的成分及含量,他们进行了如图所示实验.下列有关叙述中正确的是( )
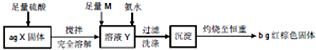

| A、取少量溶液Y,加入KSCN溶液,如果溶液不变红,则X中不含Fe3O4 | ||
| B、向钾氨水后得溶液中滴加FeCl2,如果生成红褐色沉淀,说明氨水已过量 | ||
| C、m可以是H2O2或NaClO,在实验过程中,理论上消耗两者物质的量之比为1;2 | ||
D、当b<
|
实验室需480mL 1.0mol/L的NaOH溶液,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是( )
| A、称取氢氧化钠20.0 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗 |
| D、移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方 |
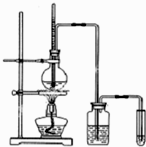 下面是实验室制乙烯并检验其性质的装置图,请回答:
下面是实验室制乙烯并检验其性质的装置图,请回答: