题目内容
铵盐在工农业生产中有着重要的用途,某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液.

(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因: .
(3)将装置C中两种液体分离开的操作名称是 .

(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:
(3)将装置C中两种液体分离开的操作名称是
考点:氨的实验室制法,铵盐
专题:
分析:(1)氨气极易溶于水,容易发生倒吸;
(2)一水合氨为弱电解质存在电离平衡NH3+H2O?NH4++OH-,增大生成物浓度平衡向逆向移动;
(3)分液可以用来分离两种互不相溶、密度不同的液体.
(2)一水合氨为弱电解质存在电离平衡NH3+H2O?NH4++OH-,增大生成物浓度平衡向逆向移动;
(3)分液可以用来分离两种互不相溶、密度不同的液体.
解答:
解:(1)氨气极易溶于水,容易发生倒吸,将氨气通入C中氨气与硫酸反应生成硫酸铵,注意应长进短出防止倒吸,过量的氨气用D装置吸收,
故答案为:d e f;
(2)一水合氨为弱电解质存在电离平衡NH3+H2O?NH4++OH-,增大生成物浓度,平衡向逆向移动,所以氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡NH3+H2O?NH4++OH-左移,有利氨气逸出,
故答案为:氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡NH3+H2O?NH4++OH-左移,有利氨气逸出;
(3)水与四氯化碳互不相溶,密度不同,硫酸铵易溶于水,可以通过分液的方法分离二者,
故答案为:分液.
故答案为:d e f;
(2)一水合氨为弱电解质存在电离平衡NH3+H2O?NH4++OH-,增大生成物浓度,平衡向逆向移动,所以氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡NH3+H2O?NH4++OH-左移,有利氨气逸出,
故答案为:氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡NH3+H2O?NH4++OH-左移,有利氨气逸出;
(3)水与四氯化碳互不相溶,密度不同,硫酸铵易溶于水,可以通过分液的方法分离二者,
故答案为:分液.
点评:本题考查了氨气的制备和性质,题目难度不大,熟悉铵盐的性质是解题关键,注意分液方法使用的条件.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、吸滤完毕或中途需停止吸滤时,应先关闭水龙头,然后拆下连接抽气泵和吸滤瓶的橡皮管 |
| B、在层析实验操作中,应沿试管壁小心地将展开剂慢慢倒入试管底部 |
| C、要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们制成热饱和溶液,降温后再过滤 |
| D、由于碘在酒精中的溶解度大,故可用酒精把碘水中的碘萃取出来 |
维生素C的结构简式为 ,它不含有的官能团是( )
,它不含有的官能团是( )
 ,它不含有的官能团是( )
,它不含有的官能团是( )| A、羧基 | B、羟基 |
| C、酯基 | D、碳碳双键 |
下列离子组在无色溶液中可以大量共存的是( )
| A、Na+、Cu2+、Cl-、NO3- |
| B、HCO3-、Na+、OH-、SO42- |
| C、H+、K+、CO32-、Cl- |
| D、H+、NO3-、Ca2+、Mg2+ |
有甲、乙、丙、丁四种溶液:甲为氯化铝溶液、乙为硫化钠溶液、丙为氢氧化钠溶液、丁为硝酸溶液,若四种溶液的pH及溶液中水的电离程度分别两两相等,则下列判断正确的是( )
| A、pH:甲与乙相等;水的电离程度:丙与丁相等 |
| B、pH:甲与丙相等;水的电离程度:乙与丁相等 |
| C、pH:甲与丁相等;水的电离程度:乙与丙相等 |
| D、pH:甲与丁、乙与丙相等;电离程度:甲与乙、丙与丁相等 |
反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)在一体积可调的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A、增加Fe的表面积 |
| B、保持体积不变,充入Ne使体系压强增大 |
| C、将容器的体积缩小一半 |
| D、保持总压强不变,充入Ne使容器的体积增大 |
下列说法正确的是( )
| A、有些活泼金属如铝可作还原法的还原剂 |
| B、用电解氯化钠溶液的方法可冶炼金属钠 |
| C、可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
| D、利用太阳能,无法将海水蒸馏淡化 |
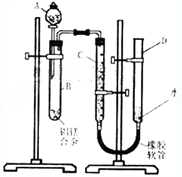 某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.