题目内容
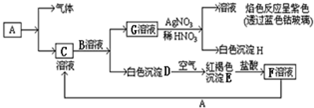
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.
试回答下列问题:
(1)FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为 ;证明蚀刻后的混合物溶液仍存在Fe3+的操作是: .
(2)过程I加入铁屑的主要作用是 ;从固体中分离出铜需采用的方法是 .
(3)过程Ⅱ中发生主要反应的化学方程式为: .
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.
试回答下列问题:
(1)FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为
(2)过程I加入铁屑的主要作用是
(3)过程Ⅱ中发生主要反应的化学方程式为:
考点:物质的检验和鉴别的基本方法选择及应用,离子方程式的书写,铁的化学性质
专题:元素及其化合物
分析:(1)氯化铁和铜反应生成氯化亚铁和氯化铜,可用KSCN检验Fe3+;
(2)过程Ⅰ加入铁屑的主要作用是和氯化铜发生反应生成铜,过滤后得到固体为Fe和Cu,加入盐酸铁反应,铜不反应过滤分离得到铜;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁.
(2)过程Ⅰ加入铁屑的主要作用是和氯化铜发生反应生成铜,过滤后得到固体为Fe和Cu,加入盐酸铁反应,铜不反应过滤分离得到铜;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁.
解答:
解:(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,
证明蚀刻后的混合物溶液仍存在Fe3+的操作是取少量反应后的溶液于小试管中,滴加KSCN溶液,如溶液变红色,则说明含有Fe3+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;取少量反应后的溶液于小试管中,滴加KSCN溶液,如溶液变红色,则说明含有Fe3+;
(2)向废液中投入过量铁屑,铁会和三氯化铁溶液反应生成氯化亚铁,和氯化铜反应生成铜和氯化亚铁,所以加入铁粉是为了得到铜,过滤得到固体是过量的铁和铜,用盐酸溶解铁反应,铜不反应过滤得到铜,
故答案为:回收铜;加入盐酸反应后过滤;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;反应的化学方程式为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
证明蚀刻后的混合物溶液仍存在Fe3+的操作是取少量反应后的溶液于小试管中,滴加KSCN溶液,如溶液变红色,则说明含有Fe3+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;取少量反应后的溶液于小试管中,滴加KSCN溶液,如溶液变红色,则说明含有Fe3+;
(2)向废液中投入过量铁屑,铁会和三氯化铁溶液反应生成氯化亚铁,和氯化铜反应生成铜和氯化亚铁,所以加入铁粉是为了得到铜,过滤得到固体是过量的铁和铜,用盐酸溶解铁反应,铜不反应过滤得到铜,
故答案为:回收铜;加入盐酸反应后过滤;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;反应的化学方程式为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查较为综合,涉及铁离子的氧化性,提取铜的反应过程和步骤分析判断,氢氧化铁氢氧化亚铁的转化反应,为高频考点,侧重学生的分析能力和实验能力的考查,注意把握物质的性质,题目难度中等.

练习册系列答案
相关题目
在体积为VL的密闭容器中通入amol NO和bmolO2.反应后容器内氮原子数和氧原子数之比为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列叙述正确的是( )
| A、常温下将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | ||
| B、常温下溶液中由水电离出的c(H+)=10-5mol/L时,溶质可能是酸或碱 | ||
| C、常温下pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈碱性 | ||
D、向醋酸钠稀溶液中加醋酸钠固体,
|
下列家庭化学小实验不能达到预期目的是( )
| A、用酸性高锰酸钾溶液鉴别乙烯和甲苯 |
| B、用醋、石灰水验证蛋壳中含有碳酸盐 |
| C、用碘酒检验汽油中是否含有不饱和烃 |
| D、用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
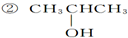
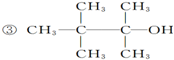
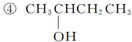
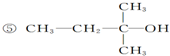
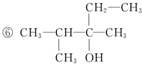
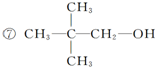
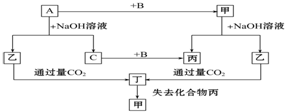 已知单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,甲是一种高熔点的物质.丙常温下是一种液体.根据图示转化关系回答:
已知单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,甲是一种高熔点的物质.丙常温下是一种液体.根据图示转化关系回答: