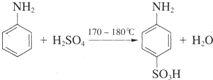
题目内容
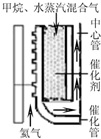 (2010?江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(2010?江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:(1)甲烷的部分氧化.其反应式如下:
CH4(g)+
| 1 |
| 2 |
则该反应的△S
>
>
0(填“>”、“<”或“=”).有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H1=-890.3kJ?mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g);△H2=247.3kJ?mol-1
③CH4(g)+H2O(g)=CO(g)+3H2(g);△H3=
250.3
250.3
kJ?mol-1(2)甲烷水蒸汽催化重整.如右上图所示热氦气从下部流入提供能量.由甲烷和水蒸汽混合气从催化管的上部流入,从下端出来后再向上进入中心管.根据下表数据计算甲烷的转化率为
55%
55%
.| 气体 | 进口温度/℃ | 进口压强/MPa | 进口流量/g?s-1 | 出口流量/g?s-1 |
| 甲烷 | 464 | 4.26 | 12 | 5.4 |
温度过高催化剂失去活性或甲烷在高温条件下分解产生炭黑影响该反应速率
温度过高催化剂失去活性或甲烷在高温条件下分解产生炭黑影响该反应速率
.(4)甲烷的部分氧化与重整耦合.以天然气为燃料的发电尾气(主要含CO2、H2O、O2 和N2)与甲烷可直接用于制合成气.下列说法错误的是
C
C
(填序号).A.直接利用烟气中的CO2,可以大规模地减少 CO2的排放量
B.发电尾气的出口温度较高,可以利用以节约能量
C.使用恰当的催化剂可以增大甲烷的转化率
D.因发电尾气反应中包含甲烷燃烧,可实现部分热量自供,可降低成本.
分析:(1)根据产物和反应物之间气体物质的量之间的关系来回答,根据盖斯定律来计算化学反应的焓变;
(2)根据出口流量和进口流量来计算甲烷的转化率;
(3)根据催化剂受温度的影响来判断反应速率明显降低的原因;
(4)根据反应中二氧化碳的量的控制以及催化剂不会改变化学平衡的移动来回答.
(2)根据出口流量和进口流量来计算甲烷的转化率;
(3)根据催化剂受温度的影响来判断反应速率明显降低的原因;
(4)根据反应中二氧化碳的量的控制以及催化剂不会改变化学平衡的移动来回答.
解答:解:(1)反应CH4(g)+
O2 (g)═CO (g)+2H2(g)前后气体体积增大的反应,熵变减少大于0;根据盖斯定律,利用题干所给的热化学方程式,结合盖斯定律得到CH4(g)+H2O(g)=CO(g)+3H2(g);△H3=250.3KJ/mol,故答案为:>;250.3;
(2)甲烷的转化率=
×100%=55%,故答案为:55%;
(3)温度过高,会使得催化剂失去活性,影响该反应速率,此外甲烷在高温条件下分解产生炭黑也影响该反应速率,故答案为:温度过高催化剂失去活性或甲烷在高温条件下分解产生炭黑影响该反应速率;
(4)A.直接利用烟气中的CO2,可以大规模地减少CO2的排放量,故A正确;
B.发电尾气的出口温度较高,可以利用此温度以节约能量,故B正确;
C.使用催化剂只可以改变化学反应速率,不可以改变甲烷的转化率,故C错误;
D.发电尾气反应中包含甲烷燃烧,该燃烧过程会放出大量的热,利用这些能量这样可实现部分热量自供,可降低成本,故D正确.
故选C.
| 1 |
| 2 |
(2)甲烷的转化率=
| 12-5.4 |
| 12 |
(3)温度过高,会使得催化剂失去活性,影响该反应速率,此外甲烷在高温条件下分解产生炭黑也影响该反应速率,故答案为:温度过高催化剂失去活性或甲烷在高温条件下分解产生炭黑影响该反应速率;
(4)A.直接利用烟气中的CO2,可以大规模地减少CO2的排放量,故A正确;
B.发电尾气的出口温度较高,可以利用此温度以节约能量,故B正确;
C.使用催化剂只可以改变化学反应速率,不可以改变甲烷的转化率,故C错误;
D.发电尾气反应中包含甲烷燃烧,该燃烧过程会放出大量的热,利用这些能量这样可实现部分热量自供,可降低成本,故D正确.
故选C.
点评:本题目是一道有关热化学知识的综合考查题,要求学生具有分析和解决问题的能力,难度大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目