题目内容
碳、硅元素的单质及其化合物是构成自然界的重要物质.
(1)甲烷是最简单的有机物,实验室可通讨下列反应制取:CH3COONa+NaOH
CH4↑+X(已配平)
X属于 晶体(填晶体类型).
(2)金刚石和石墨是两种重要的碳单质.
①以Ni-Cr-Fe为催化剂,一定条件下可将石墨转化为金刚石.基态Cr3+离子中未成对电子数有 个.
②石墨晶体能导电,导电的粒子是 .
(3)甲硅烷(SiH4)的结构与甲烷相似,甲硅烷能与硝酸银发生如下反应:
SiH4+8AgNO3+2H2O═8Ag↓+SiO2↓+8HNO3
该反应中氢元素被氧化,由此可判断电负性:Si H(填“>”、“<”或“=”)
(1)甲烷是最简单的有机物,实验室可通讨下列反应制取:CH3COONa+NaOH
| CaO(或MgO) |
| △ |
X属于
(2)金刚石和石墨是两种重要的碳单质.
①以Ni-Cr-Fe为催化剂,一定条件下可将石墨转化为金刚石.基态Cr3+离子中未成对电子数有
②石墨晶体能导电,导电的粒子是
(3)甲硅烷(SiH4)的结构与甲烷相似,甲硅烷能与硝酸银发生如下反应:
SiH4+8AgNO3+2H2O═8Ag↓+SiO2↓+8HNO3
该反应中氢元素被氧化,由此可判断电负性:Si
考点:碳族元素简介,原子核外电子排布,元素电离能、电负性的含义及应用,离子晶体
专题:
分析:(1)根据原子守恒判断X物质,根据X的构成微粒确定其晶体类型;
(2)①根据基态Cr3+离子的电子排布式分析;1s22s22p63s23p63d3;
②金属晶体中能导电的粒子是自由电子;
(3)阴离子还原性越强的元素,其非金属性越弱.
(2)①根据基态Cr3+离子的电子排布式分析;1s22s22p63s23p63d3;
②金属晶体中能导电的粒子是自由电子;
(3)阴离子还原性越强的元素,其非金属性越弱.
解答:
解:(1)根据元素守恒及原子守恒知,X是碳酸钠,碳酸钠是由阴阳离子构成的离子晶体,故答案为:离子;
(2)①基态Cr3+离子的电子排布式为:1s22s22p63s23p63d3,其3d轨道上有3个未成对电子,故答案为:3;
②金属晶体中能导电的粒子是自由电子,石墨晶体具有层状结构,质软、熔点高、能导电,其导电原理同金属晶体,则其导电的粒子是自由电子,故答案为:自由电子;
(3)阴离子还原性越强的元素,其非金属性越弱,该反应中硅元素被氧化,所以非金属性Si比H弱,故答案为:<.
(2)①基态Cr3+离子的电子排布式为:1s22s22p63s23p63d3,其3d轨道上有3个未成对电子,故答案为:3;
②金属晶体中能导电的粒子是自由电子,石墨晶体具有层状结构,质软、熔点高、能导电,其导电原理同金属晶体,则其导电的粒子是自由电子,故答案为:自由电子;
(3)阴离子还原性越强的元素,其非金属性越弱,该反应中硅元素被氧化,所以非金属性Si比H弱,故答案为:<.
点评:本题考查晶体类型判断、原子核外电子排布以及非金属性比较等知识点,注意仔细审题,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是( )
| A、将混合气体通过盛有硫酸的洗气瓶 |
| B、将混合气体通过盛有足量溴水的洗气瓶 |
| C、将混合气体通过盛有酸性KMnO4溶液的洗气瓶 |
| D、将混合气体通过盛有澄清石灰水的洗气瓶 |
一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g)△H<0.现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
| B、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
| D、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
在4NH4+5O2?4NO+6H2O反应中,表示该反应速率最快的是( )
| A、υ(NH4)=0.8 mol/(L?s) |
| B、υ(O2)=1.0 mol/(L?s) |
| C、υ(NO)=1.0 mol/(L?s) |
| D、υ(H2O)=1.8 mol/(L?s) |
下列物质加入水中显著放热的是( )
| A、浓硫酸 |
| B、固体NaCl |
| C、无水乙醇 |
| D、固体NH4NO3 |
下列有关化学实验的叙述正确的是( )
| A、用带玻璃塞的试剂瓶保存Na2CO3溶液 |
| B、配制FeCl3溶液时,向溶液中加入少量铁粉和稀盐酸 |
| C、在铁件表面镀铜时,用铁件作阴极、铜作阳极、稀硫酸作电镀液 |
| D、实验室进行肥皂反应时,在油脂和氢氧化钠的混合液中加入适量酒精 |
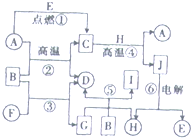 物质A~J之间的转化关系如图所示,其中A、F、H为常见的金属单质,D、E为常见的非金属气态单质,其余的为化合物,且单质E和单质F在点燃条件下可生成淡黄色固体,B在常温常压下为液态化合物.试回答下列问题:
物质A~J之间的转化关系如图所示,其中A、F、H为常见的金属单质,D、E为常见的非金属气态单质,其余的为化合物,且单质E和单质F在点燃条件下可生成淡黄色固体,B在常温常压下为液态化合物.试回答下列问题: