题目内容
16.如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为:B>A | |
| B. | D、E形成的简单离子的还原性:E>D | |
| C. | 气态氢化物的稳定性:D<C | |
| D. | 最高价氧化物对应的水化物的酸性:C>E |
分析 短周期元素,由元素的化合价可知,D、E为-1价,则D为F元素,E为Cl元素;C主要化合价为-2、+6价,可知C为S元素,A为+2价,原子半径大于S元素,故A为Mg元素;B为+3价,原子半径小于Mg大于S,故B为Al元素.
A.同周期从左到右,离子半径逐渐减小;
B.非金属性越强,阴离子的还原性越弱;
C.非金属性越强,氢化物越稳定;
D.非金属性越强,最高价氧化物对应的水化物的酸性越强.
解答 解:短周期元素,由元素的化合价可知,D、E为-1价,则D为F元素,E为Cl元素;C主要化合价为-2、+6价,可知C为S元素,A为+2价,原子半径等于S元素,故A为Mg元素;B为+3价,原子半径小于Mg大于S,故B为Al元素.
A.同周期从左到右,离子半径逐渐减小,A、B简单离子半径大小关系为:A>B,故A错误;
B.非金属性F>Cl,非金属性越强,阴离子的还原性越弱,D、E形成的简单离子的还原性E->D-,故B正确;
C.非金属性F>S,非金属性越强,氢化物越稳定,气态氢化物的稳定性HD>H2C,故C错误;
D.非金属性Cl>S,非金属性越强,最高价氧化物对应的水化物的酸性越强,酸性H2CO4<HEO4,故D错误.
故选:B.
点评 本题考查元素原子结构与性质、元素周期律等,学生能利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉掌握同周期、同主族元素性质递变规律来解答即可,难度不大.

练习册系列答案
相关题目
7.图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为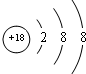
(2)地壳中含量最多的金属元素的名称是铝
(3)用电子式表示②与④形成化合物的过程 .
.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式作答,下同),碱性最强的是KOH.
(5)写出⑤与氢氧化钠反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:Al (OH)3+OH-=AlO2-+2H2O.
(6)②和⑥,②和⑨形成的化合物含有的化学键类型分别是共价键,离子键.
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)地壳中含量最多的金属元素的名称是铝
(3)用电子式表示②与④形成化合物的过程
 .
.(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式作答,下同),碱性最强的是KOH.
(5)写出⑤与氢氧化钠反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:Al (OH)3+OH-=AlO2-+2H2O.
(6)②和⑥,②和⑨形成的化合物含有的化学键类型分别是共价键,离子键.
11.下列微粒中,键角最大的是( )
| A. | NH4+ | B. | H3O+ | C. | CO2 | D. | CCl4 |
1.在测溶液的性质时,下列试纸中预先不能用蒸馏水润湿的是( )
| A. | 石蕊试纸 | B. | PH试纸 | C. | KI淀粉试纸 | D. | 醋酸铅试纸 |
8.已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 氢化物的稳定性H2Y>HZ | B. | 离子半径W3+<Z-,第一电离能X<W | ||
| C. | W、X、Y、Z最高正价与族序数相等 | D. | 电负性Z<Y<W<X |
5.下列有关“化学与生活”的叙述不正确的是( )
| A. | 漂白粉漂白织物利用了物质氧化性 | |
| B. | 点燃爆竹后,硫燃烧生成SO2 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | PX项目的主要产品对二甲苯属于不饱和烃 |
6.化学反应总是伴随着丰富多彩的颜色的变化,下列说法错误的是( )
| A. | 将Na2O2固体投入滴加了少许酚酞的蒸馏水中,溶液先变红后褪色 | |
| B. | 向胆矾晶体(CuSO4•5H2O)滴加浓硫酸,晶体由蓝色变为黑色 | |
| C. | 用玻璃棒蘸取浓硝酸滴加到pH试纸上,试纸先变红后变成白色 | |
| D. | 将SO2通入品红溶液中,溶液颜色褪去,加热后又变成红色 |
 .
.