题目内容
某实验小组研究可逆反应AsO43—+2I—+2H+ AsO33—+I2+H2O时,设计了如图所示的原电池:
AsO33—+I2+H2O时,设计了如图所示的原电池:
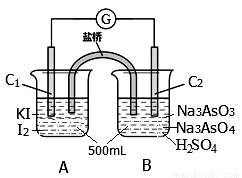
(1)电池工作时,盐桥中的阴离子向 极移动(填C1或C2);若向B池里滴加NaOH溶液,平衡向 方向移动,此时C2极的电极反应式为 。
(2)下 列判断正确的是 。
列判断正确的是 。
a.微安表指针为0时,该反应处于平衡状态。
b.向A池中加入淀粉溶液,溶液变蓝说明该反应处于平衡状态。
c.AsO43—、AsO33—离子浓度相等时,该反应处于平衡状态。
(3)若在5min时间内电路中通过了1.204×104库伦电量,用I—浓度的变化来表示的化学反应速率为 。
(4)该反应的平衡常数表达式K= 。若升高温度,K值增大,则正反应的△H 0。(填“>”、“<”或“=”)
(5)已知反应达到平衡时,AsO43—离子转化率为25%,则I—离子的转化率 。
A.大于25% B.小于25% c.等于25% d无法确定
(6)反应达到平衡后,若将AsO43—、I—、H+、AsO33—、I2的浓度均减少到原来的一半,上述平衡向 方向移动。
练习册系列答案
相关题目



 阿伏加德罗常数的值,下列说法正确的是
阿伏加德罗常数的值,下列说法正确的是 和活泼金属反应时主要得到NO
和活泼金属反应时主要得到NO