题目内容
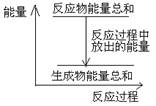
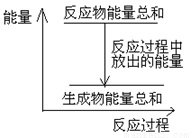
对于敞口容器中的反应:Zn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g), 反应过程中能量关系可用右图表示,下列叙述中不正确的是 ( )
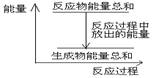
A.1 molZn的能量高于1 molH2的能量
B.反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量
C.如果Zn足量,反应速率会经历由慢到快到慢的过程
D.用锌粉代替锌粒,速率会加快
【答案】
A
【解析】根据图像可知,反应物的总能量高于生成物的总能量,所以是放热反应,A不正确,B正确。开始溶液温度逐渐升高,反应速率逐渐加快,后来氢离子浓度逐渐降低,反应速率又逐渐降低,C正确。增大反应物的接触面积,加快反应速率,D正确,所以正确的答案是A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对于敞口容器中的反应:Zn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g),下列叙述中不正确的是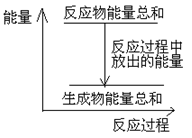
| A.Zn和H2SO4的总能量大于 ZnSO4和H2的总能量 |
| B.反应过程中能量关系可用上图表示 |
| C.若将该反应设计成原电池,则Zn为负极 |
| D.若将该反应设计成原电池,当有65g锌溶解时,正极放出11.2L气体 |