��Ŀ����
����Ŀ��ij��Ӧ�з�Ӧ������������FeCl2��FeCl3��CuCl2��Cu
��1����������Ӧ��Ƴɵ�ԭ�����ͼ����ʾ����ش��������⣺
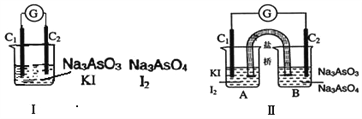
��ͼ��X��Һ��______________________��
��Cu�缫�Ϸ����ĵ缫��ӦʽΪ_________________��
��ԭ��ع���ʱ�������е�_______________���ӣ��K+����Cl-�������Ͻ���X��Һ�С�
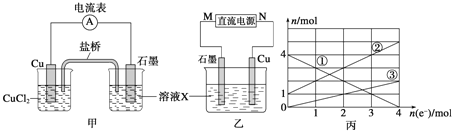
��2����������Ӧ��Ƴɵĵ�����ͼ����ʾ�����ձ��н��������ӵ����ʵ��������ת�Ƶ����ʵ����ı仯��ϵ��ͼ������ش��������⣺
��M��___________����
��ͼ���еĢ�����_______________���ӵı仯��
�۵�����ת��Ϊ2molʱ�������ձ��м���_________L 5mol��L-1NaOH��Һ����ʹ���еĽ��������ӳ�����ȫ��
��3������ԭ��ع���ԭ���ⶨ����β����CO��Ũ�ȣ���װ����ͼ��ʾ���õ����O2-�����ڹ������NASICON�������壩�������ƶ�������ʱO2-���ƶ�����_____________�����a��b����b��a���������������ĵ缫��ӦʽΪ____________________��

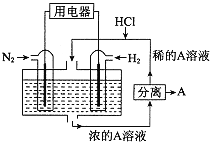
��4������������N2��H2Ϊ��Ӧ�������A��ϡ����Ϊ�������Һ��������������ṩ���ܣ����̵ܹ�������ȼ�ϵ�أ�װ����ͼ��ʾ����������ĵ缫��Ӧʽ��_________________________��A��___________________��
���𰸡� FeCl3�� FeCl2 Cu-2e-=Cu2+ K+ �� Fe2+ 2.8 ��b��a CO-2e-+O2-=CO2 N2+6e-+8H+=2NH4+ NH4Cl
�������������������1�����Ȼ�������ǿ�����ԣ�ͭ�ܱ��Ȼ�����������ӦΪ��ӦΪ2FeCl3+Cu=CuCl2+2FeCl2����Cu���Ȼ�����Ӧ��ͭʧ���ӷ���������Ӧ������������ʯī�����������������������������ƶ�����2�����ݱ�ͼ��֪��Һ�������ֽ��������ӣ�������X�ijɷֿ�֪X��ֻ�����ֽ��������ӣ�˵���ڵ������л���Cu2+���ɣ����Cu��������ʯī������������ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯ȷ�����߶�Ӧ�����ӣ����ת�Ƶ��ӵ����ʵ������㣻��3��һ����̼�����γ�ȼ�ϵ�أ�һ����̼��������Ӧ���ɶ�����̼��ͨ��CO��һ���Ǹ�����ͨ��������һ����������ԭ��طŵ�ʱ���������ƶ�����4�����������ʧ���ӣ��ڸ�������������Ӧ�������õ���������������ԭ��Ӧ��������HCl��Ӧ�����Ȼ�泥���������ҺΪ�Ȼ����
��������1�����Ȼ�������ǿ�����ԣ�ͭ�ܱ��Ȼ������������Է�ӦΪ2FeCl3+Cu=CuCl2+2FeCl2����FeCl3��ҺΪ�������Һ����Cu��������ʧ���ӷ���������Ӧ���缫��ӦΪCu-2e-=Cu2+����ʯī���������ŵ�ʱ���������������������������е�������K+����X��Һ�У���2���ٸ��ݱ�ͼ��֪��Һ�������ֽ��������ӣ�������X�ijɷֿ�֪X��ֻ�����ֽ��������ӣ�˵���ڵ������л���Cu2+���ɣ����Cu��������ʯī������������M�Ǹ������ڸ���ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯����֪��ΪFe3+����ΪFe2+����ΪCu2+��������ת��Ϊ2molʱ����Һ����Fe3+2mol��Fe2+3mol��Cu2+Ϊ1mol��������Ҫ����NaOH��Һ14mol������NaOH��Һ�����Ϊ![]() 2.8L����3������ͼ��֪��һ����̼�����γ�ȼ�ϵ�أ�һ����̼ʧ���Ӻ������ӷ�Ӧ���ɶ�����̼����������Ӧ���缫��ӦʽCO-2e-+O2-=CO2������һ����̼���ڼ�Ϊ������ͨ�������һ��Ϊ������ԭ��طŵ�ʱ���������ƶ������Թ���ʱO2-���ƶ������b��a����4�����������ʧ���ӣ��ڸ�������������Ӧ�������õ���������������ԭ��Ӧ����������ӦʽΪN2+8H++6e-=2NH4+��������HCl��Ӧ�����Ȼ�泥���������ҺΪNH4Cl��Һ��
2.8L����3������ͼ��֪��һ����̼�����γ�ȼ�ϵ�أ�һ����̼ʧ���Ӻ������ӷ�Ӧ���ɶ�����̼����������Ӧ���缫��ӦʽCO-2e-+O2-=CO2������һ����̼���ڼ�Ϊ������ͨ�������һ��Ϊ������ԭ��طŵ�ʱ���������ƶ������Թ���ʱO2-���ƶ������b��a����4�����������ʧ���ӣ��ڸ�������������Ӧ�������õ���������������ԭ��Ӧ����������ӦʽΪN2+8H++6e-=2NH4+��������HCl��Ӧ�����Ȼ�泥���������ҺΪNH4Cl��Һ��

 ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�