题目内容
根据下式所表示的氧化还原反应设计一个原电池:2FeCl3(aq)+Cu(s)=2FeCl2(aq)+CuCl2(aq)
(1)装置可采用烧杯和盐桥,画出此原电池的装置简图;
(2)注明原电池的正极和负极;
(3)注明外电路中电子的流向;
(4)写出两个电极上的电极反应.
(1)装置可采用烧杯和盐桥,画出此原电池的装置简图;
(2)注明原电池的正极和负极;
(3)注明外电路中电子的流向;
(4)写出两个电极上的电极反应.
考点:设计原电池
专题:电化学专题
分析:该反应中,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极,不如Cu活泼的金属或导电的非金属作正极,氧化反应的烧杯中选择氯化铜为电解质,还原反应中选择FeCl3溶液为电解质溶液,以此解答该题.
解答:
解:该反应中,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极,不如Cu活泼的金属或导电的非金属作正极,氧化反应的烧杯中选择氯化铜为电解质,还原反应中选择FeCl3溶液为电解质溶液,装置图为 ,负极反应为Cu-2e-=Cu2+,正极反应为2Fe3++2e-=2Fe2+,
,负极反应为Cu-2e-=Cu2+,正极反应为2Fe3++2e-=2Fe2+,
答:装置图为 ,负极反应为Cu-2e-=Cu2+,正极反应为2Fe3++2e-=2Fe2+.
,负极反应为Cu-2e-=Cu2+,正极反应为2Fe3++2e-=2Fe2+.
 ,负极反应为Cu-2e-=Cu2+,正极反应为2Fe3++2e-=2Fe2+,
,负极反应为Cu-2e-=Cu2+,正极反应为2Fe3++2e-=2Fe2+,答:装置图为
 ,负极反应为Cu-2e-=Cu2+,正极反应为2Fe3++2e-=2Fe2+.
,负极反应为Cu-2e-=Cu2+,正极反应为2Fe3++2e-=2Fe2+.
点评:本题考查了原电池设计,根据方程式中得失电子的物质判断负极极电解质,方程式中失电子化合价升高的金属单质作负极,注意利用盐桥设计原电池时两个烧杯中电解质的选择为解答的难点,题目难度中等.

练习册系列答案
相关题目
对于药品的使用和作用下列说法不正确的是( )
| A、R表示处方药,OTC表示非处方药 |
| B、毒品就是有毒的药品 |
| C、我国明代医学家李时珍所著的医学名著是《神农本草经》 |
| D、麻黄碱是国际奥委会严格禁止使用的兴奋剂 |
下列说法正确的是( )
| A、葡萄糖作为营养剂供给人体能量,在体内发生的主要反应是氧化反应 |
| B、药物能治疗疾病,故多吃点没关系 |
| C、鸦片、吗啡、海洛因等毒品危害极大,人们特别是青少年一定要远离毒品 |
| D、为了预防、治疗疾病,家庭应自备一些常用的非处方药,以供急用 |
 下列制取气体的方案,可以直接采用如图所示装置进行的是
下列制取气体的方案,可以直接采用如图所示装置进行的是①用H2O2和MnO2制取O2;②用CaCO3和稀盐酸制取CO2;③用KClO3和MnO2制取O2;④用Zn和稀硫酸制取H2;⑤用Cu和浓硝酸制取NO2( )
| A、①④ | B、②③④ |
| C、①②⑤ | D、①②④⑤ |
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述正确的是( )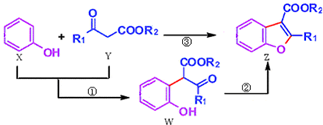

| A、反应①属于加成反应 |
| B、X分子式为C6H6O |
| C、X、Y、W、Z都能与NaOH溶液反应 |
| D、可用溴水或FeCl3溶液鉴别X和W |
同温同压下,已知下列各反应为放热反应,下列各热化学方程式中△H最小的是( )
| A、2A (l)+B (l)=2C (g)△H1 |
| B、2A (g)+B (g)=2C(g)△H2 |
| C、2A (g)+B (g)=2C (l)△H3 |
| D、2A (l)+B (l)=2C(l)△H4 |
 用系统命名法命名
用系统命名法命名 中含有的官能团的名称为
中含有的官能团的名称为