题目内容
已知Fe3+与I-在水溶液中发生:2I-+2Fe3+=2Fe2++I2。该反应正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)·cn(Fe3+)(其中k为常数)。
| cm(I-)(mol/L)m | cn(Fe3+)[(mol/L)n] | v[mol/(L·s)] | |
| a | 0.20 | 0.80 | 0.032 |
| b | 0.60 | 0.40 | 0.144 |
| c | 0.80 | 0.20 | 0.128 |
将a和b中的数据带入v=kcm(I-)·cn(Fe3+)可知,m=n+1,所以I-浓度对反应速率的影响大于Fe3+浓度对反应速率的影响。

 阅读快车系列答案
阅读快车系列答案(12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法:
I.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。具体流程如下:
有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式__________________。
(2)还原+6价铬还可选用以下的________________试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
II.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式______________________________________。
(5)电解法中加入氯化钠的作用是:_______________________________________。
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:
已知Fe3+、Mn2+沉淀的pH如右表所示。
|
| 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为 。
(2)控制pH的操作中m的值为 。
II、用MnFe2O4热化学循环制取氢气:
(3)由上可知,H2燃烧的热化学方程式是 。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
A.过程简单、无污染 B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。
反应①
反应②:
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是 。
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:
已知Fe3+、Mn2+沉淀的pH如右表所示。
| | 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
(2)控制pH的操作中m的值为 。
II、用MnFe2O4热化学循环制取氢气:
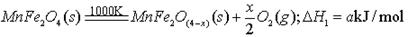
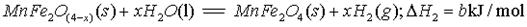
(3)由上可知,H2燃烧的热化学方程式是 。
(4)该热化学循环制取氢气的优点是
 (填字母编号)。
(填字母编号)。A.过程简单、无污染
 B.物料可循环使用
B.物料可循环使用C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。
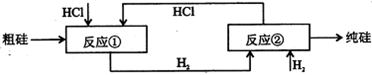
反应①
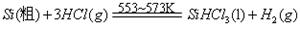
反应②:
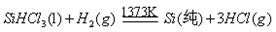
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是 。
已知Fe3+与I-在水溶液中发生:2I-+2Fe3+=2Fe2++I2。该反应正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)·cn(Fe3+)(其中k为常数)。
| cm(I-)(mol/L)m | cn(Fe3+)[(mol/L)n] | v[mol/(L·s)] | |
| a | 0.20 | 0.80 | 0.032 |
| b | 0.60 | 0.40 | 0.144 |
| c | 0.80 | 0.20 | 0.128 |
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响(填大于或小于或等于)