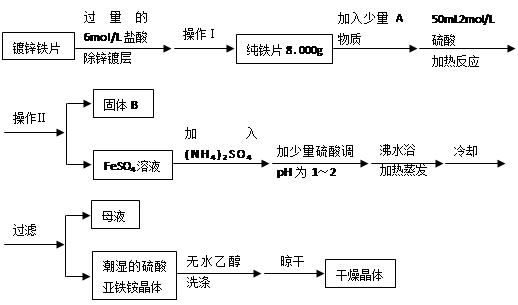
题目内容
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:??????????????????????????????????????????????? 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;
SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。

上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在????? (选填“0℃、25℃、50℃”),装置Ⅱ的作用是??????????? 。
②装置Ⅲ中的试剂可以是??????? (选填序号,下同),现象是????????????? ,则证明气体产物中含有SO2; 装置Ⅳ中的试剂可以是????????? 。
A. 2 mol/LNa2CO3溶液
B. 品红溶液
C. 0.5 mol/L BaCl2溶液?
D. 0.5 mol/LBa(NO3)2
E. 0.01 mol/L KMnO4溶液
F. 淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为??????????????????????????? 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如
下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入??? ?????????? 。 | ? ????????????????????????? | ????? 固体中含有Fe2O3 |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液。 | ???????? 产生蓝色沉淀 | ?????????????????????????? |
⑤若用22.8 g FeSO4固体做实验,完全分解后,得到11.2 g固体,其中Fe2O3的质量分数=??????????
(精确到0.1%)
(1)4(FeSO4·7H2O)+ O2= 4Fe(OH)SO4 + 26H2O
(2)① 50℃,防止产生倒吸(或“用作安全瓶”)
② C, 产生白色沉淀, B、E
③ SO2 + 2OHˉ=SO32ˉ+ H2O
④
操作步骤 | 预期实验现象 | 预期实验结论 |
KSCN溶液(或硫氰化钾溶液)? | ????? 溶液变成血红色 |
|
|
| ???? 固体中含有FeO |
⑤ 35.7%
【解析】
试题分析:(1)Fe2+有还原性,容易被空气中的氧气氧化为Fe3+. 根据题意该反应的化学方程式为4(FeSO4·7H2O)+ O2= 4Fe(OH)SO4 + 26H2O。(2)①反应的产物Fe2O3留在试管中,而SO2、SO3则以气体的形式从试管中出来,若Ⅱ装置烧杯中水的在0℃、25℃,SO3就会变为固体单质,导致装置中的气体压强变小,而引起倒吸现象的反应。因此Ⅱ装置温度应控制在50℃就可以保证SO3的气态形式。Ⅱ装置的作用就是防止产生倒吸(或“用作安全瓶”)。 ②无论是哪种分解方式都会产生SO3,SO3溶于水产生硫酸。所以装置Ⅲ中的试剂可以是C(BaCl2),反应的离子方程式为:Ba2++SO42-=BaSO4↓。会看到产生白色沉淀。若要证明气体产物中含有SO2,可以利用其漂白性,把气体通入品红溶液中,看到品红溶液褪色;或利用其还原性,把气体通入到酸性高锰酸钾溶液。看见溶液的紫色褪去。因此装置Ⅳ中的试剂可以是B、E。③SO2是大气污染物,在排放到空气之前要进行尾气处理。因为它的水溶液显酸性,所以常用碱溶液来吸收处理,若装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2 + 2OHˉ =SO32ˉ+ H2O 。④若固体是Fe2O3,加入硫酸时发生反应:Fe2O3+3H2SO4= Fe2 (SO4) 3+3H2O.产生的Fe3+遇到SCN-溶液时会发生颜色变化产生血红色的Fe(SCN)3. 若向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液,产生蓝色沉淀。则证明含有固体中含有FeO。反应的离子方程式为FeO+4H+= Fe2++H2O. 3Fe2++2[Fe(CN)6]3-= Fe3[Fe(CN)6]2 ↓. Fe3[Fe(CN)6]2是蓝色难溶性的物质。⑤n (FeSO4)=22.8 g÷152 g/mol =0.15mol., 假设所得固体中Fe2O3的质量为x,FeO质量为y,则x+y=11.2; 2x÷160+ y÷72=0.15解得x=4 ;y-7.2,所以Fe2O3的质量分数为(4÷11.2)×100%=35.7%.
考点:考查Fe2+的性质、离子方程式的书写、尾气的处理、Fe2+ 和Fe3+、SO3和SO2的检验方法、试剂的选择与使用及混合物中某成分含量的测定等知识。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2—3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50—80 ℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2—3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
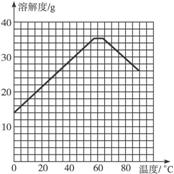
图6-11
(1)实验步骤①的目的是______________,加热的作用是__________________________。
(2)实验步骤②明显不合理,理由是_______________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是________________;__________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O、和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在57.6 ℃、64 ℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
温度/ ℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.03 | 0.5 | 27 | |
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | ||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为_________。
硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO4?X H2O,并测定该晶体中结晶水含量.请回答下列问题:
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a H2O )对制取硫酸亚铁有无影响______(填“有”或“无”.其原因是______,该步实验的关键是保证______过量(填“硫酸”或“铁屑”);
(2)FeSO4在不同温度下溶解度如下表所示:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
(A)冷却 (B)蒸发
(C)结晶 (D)洗涤 (E)过滤
(3)以下是测定FeSO4?xH2O中结晶水含量的实验流程.(称量仪器为电子天平)
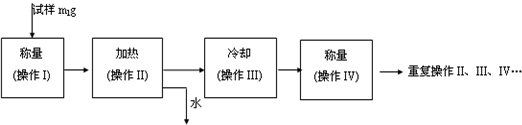
①其加热装置正确的是______
②重复操作II、III、IV,直到连续两次称量结果相差不超过______g;
③操作III必须要在______中(填仪器名称)进行.
(4)以下结晶水含量测定操作正确的是______;
A、加热时,晶体溅出坩埚,再加些FeSO4?xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现______;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气______.