题目内容
(1)在中和热测定实验中,环形玻璃搅拌棒搅拌溶液的方法是 ;不能用铜丝搅拌棒代替的原因是 ;实验中需要用到量筒的个数为 ;反应的终止温度为 .
(2)写出NaOH稀溶液与稀硫酸反应的热化学方程式 .
(2)写出NaOH稀溶液与稀硫酸反应的热化学方程式
考点:中和热的测定
专题:
分析:(1)环形玻璃搅拌棒搅拌溶液的方法是上下搅拌,使溶液混合均匀;根据金属的导热性很好,会导致热量的散失;为减少误差,量取酸、碱用不同的量筒;反应的终止温度为最高温度;
(2)依据酸碱中和反应的特征和热化学方程式的书写原则得到;
(2)依据酸碱中和反应的特征和热化学方程式的书写原则得到;
解答:
解:(1)在中和热测定实验中,环形玻璃搅拌棒搅拌溶液的方法是上下搅拌,使溶液混合均匀;用环形铜丝搅拌棒代替环形玻璃搅拌棒,金属的导热性很好,会导致热量的散失,使测得的△H数值偏小;为减少误差,量取酸、碱用两个不同的量筒;反应的终止温度为最高温度;
故答案为:上下搅拌;金属的导热性很好,会导致热量的散失;2;最高温度;
(2)稀盐酸和NaOH稀溶液反应生成1mol水放热57.3KJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol;
故答案为:上下搅拌;金属的导热性很好,会导致热量的散失;2;最高温度;
(2)稀盐酸和NaOH稀溶液反应生成1mol水放热57.3KJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol;
点评:本题主要考查了中和热实验操作以及中和热的概念,难度不大,注意实验原理的掌握.

练习册系列答案
相关题目
某溶液中含有Ba2+、HCO3-、Cl-、NO3-四种离子,先向溶液中加入足量NaOH,再加入足量稀盐酸;溶液中大量减少的离子是( )
| A、Ba2+ |
| B、Cl- |
| C、HCO3- |
| D、NO3- |
已知H-H,H-O,和O═O键的键能分别为436KJ.mol-1,463KJ.mol-1,495KJ.mol-1,下列热化学方程式正确的是( )
A、H2O(g)═H2(g)+1
| ||
B、H2O(g)═H2(g)+
| ||
| C、2 H2(g)+O2(g)═2 H2O(g)△H=+485 KJ.mol-1 | ||
| D、2 H2(g)+O2(g)═2 H2O(g)△H=-485 KJ.mol-1 |
有一无色混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-、H+,现取三份100mL溶液进行如下实验:
(1)第一份加入足量AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
(1)第一份加入足量AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A、K+一定存在 |
| B、100mL溶液中含0.01mol CO32- |
| C、Cl-一定存在 |
| D、Fe3+一定不存在,Mg2+可能存在 |
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )


| A、溴酸银的溶解是放热过程 |
| B、温度升高时溴酸银溶解速度加快 |
| C、60℃时溴酸银的KSP约等于6.25×10-4 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |

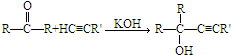 已知:
已知: