��Ŀ����
(10��)ͨ�����ǰѲ�1mol ij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H����
| ��ѧ�� | Cl��Cl | H��H | H��Cl | N��N |
| ����/kJ��mol | 243 | 436 | 431 | 946 |
a 2HCl(g) �� H2(g)��Cl2(g)����H=
b N2 (g)+3H2(g)= 2NH3(g) ��H="-92" kJ/mol����N��H���ļ����� kJ��mol
��2��1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ
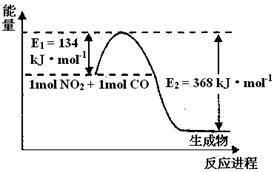
��3�� ��֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2
�� H2O(g) �� H2O(l) ��H3
��CH3OH(l)��O2(g)=" CO(g)" + 2H2O(l)��H = ���ú���H1����H2����H3��ʽ�ӱ�ʾ��
(4)��֪��2Al (s)+ 3/2O2��g��==Al2O3(s) ��H=" -1" 644.3 kJ? mol-1
2Fe (s) +3/2O2��g��==Fe2O3(s) ��H=" -815.88" kJ? mol-1
��д����������������ĩ�������ȷ�Ӧ���Ȼ�ѧ����ʽ_______________________��
��1����H ="+183" kJ/mol ��2�֣� 391��2�֣�
��2��NO2(g) + CO(g) = CO2(g) + NO(g) ��H =" -" 234kJ��mol-1��2�֣�
��3��1/2��H1-1/2/��H2+2��H3��2�֣�
��4��2Al (s) + Fe2O3(s) === Al2O3(s) +2Fe (s) ��H=" -828.42" kJ mol-1��2�֣�
����

(10��)ͨ�����ǰѲ�1mol ij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H����
| ��ѧ�� | Cl��Cl | H��H | H��Cl | N��N |
| ����/kJ��mol | 243 | 436 | 431 | 946 |
��1����Ҫ��������
a 2HCl(g) �� H2(g)��Cl2(g)����H=
b N2 (g)+3H2(g) =2NH3(g) ��H=-92kJ/mol����N��H���ļ����� kJ��mol
��2��1 mol NO2��1molCO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ
��3�� ��֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2
�� H2O(g) �� H2O(l) ��H3
��CH3OH(l)��O2(g)=CO(g) + 2H2O(l)��H = ���ú���H1����H2����H3��ʽ�ӱ�ʾ��
(4) ��֪��2Al (s)+ 3/2O2��g��==Al2O3(s) ��H= -1 644.3 kJ• mol-1
2Fe (s) +3/2O2��g��==Fe2O3(s) ��H= -815.88 kJ• mol-1
��д����������������ĩ�������ȷ�Ӧ���Ȼ�ѧ����ʽ_______________________��
(10��)��A��B��C��D��E��F����Ԫ�أ���֪��
������λ��������ͬ�����ڣ��˵������������ ��B��Fͬ���塣
��B��C�ֱ�����D��ԭ�Ӹ�����1��1��1��2�γɻ����
��A��E�ֱ�����D��ԭ�Ӹ�����1��1��2��1�γɻ����
��EԪ�صĵ������������� (kJ��mol��1)��
| I1 | I2 | I3 | I4 | �� |
| 496 | 4562 | 6912 | 9540 | �� |
(2)B2A2�����д���______���Ҽ���______���м���
(3)����ͨ���Ѳ�1 molij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�������ڼ��㻯ѧ��Ӧ�ķ�Ӧ��(��H)����ѧ��Ӧ�Ħ�H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ�±��г�����������Ԫ���γɵĻ�ѧ���ļ��ܣ�
| ��ѧ�� | F��D | F��F | B��B | F��B | C��D | D��D |
| ����/kJ��mol��1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
(10��)��A��B��C��D��E��F����Ԫ�أ���֪��
������λ��������ͬ�����ڣ��˵������������ ��B��Fͬ���塣
��B��C�ֱ�����D��ԭ�Ӹ�����1��1��1��2�γɻ����
��A��E�ֱ�����D��ԭ�Ӹ�����1��1��2��1�γɻ����
��EԪ�صĵ������������� (kJ��mol��1)��
|
I1 |
I2 |
I3 |
I4 |
�� |
|
496 |
4562 |
6912 |
9540 |
�� |
(1)д��ֻ����A��B��D��E����Ԫ�ص�������ˮ�εĻ�ѧʽ__________��__________��
(2)B2A2�����д���______���Ҽ���______���м���
(3)����ͨ���Ѳ�1 molij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�������ڼ��㻯ѧ��Ӧ�ķ�Ӧ��(��H)����ѧ��Ӧ�Ħ�H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ�±��г�����������Ԫ���γɵĻ�ѧ���ļ��ܣ�
|
��ѧ�� |
F��D |
F��F |
B��B |
F��B |
C��D |
D��D |
|
����/kJ��mol��1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
�Լ���1 mol F���ʾ���ȼ��ʱ�ķ�Ӧ�Ȧ�H=_____ (Ҫд��λ)��
(10��)ͨ�����ǰѲ�1mol ij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H����
|
��ѧ�� |
Cl��Cl |
H��H |
H��Cl |
N��N |
|
����/kJ��mol |
243 |
436 |
431 |
946 |
��1����Ҫ��������
a 2HCl(g) �� H2(g)��Cl2(g)����H=
b N2 (g)+3H2(g) = 2NH3(g) ��H=-92 kJ/mol����N��H���ļ����� kJ��mol
��2��1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ

��3�� ��֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2
�� H2O(g) �� H2O(l) ��H3
��CH3OH(l)��O2(g)= CO(g) + 2H2O(l)��H = ���ú���H1����H2����H3��ʽ�ӱ�ʾ��
(4) ��֪��2Al (s)+ 3/2O2��g��==Al2O3(s) ��H= -1 644.3 kJ• mol-1
2Fe (s) +3/2O2��g��==Fe2O3(s) ��H= -815.88 kJ• mol-1
��д����������������ĩ�������ȷ�Ӧ���Ȼ�ѧ����ʽ_______________________��