题目内容
13.暗紫色化合物A可作为电极材料的新型超铁电磁,因具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视.在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀.为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验.经组成分析,该粉末仅含有O、K、Fe三种元素.另取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g.
(1)3.96g化合物A中含有Fe元素的物质的量为0.02mol,含有钾元素的物质的量为0.04mol.化合物A的化学式为K2FeO4;
(2)化合物A与H2O反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-.
(3)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案将适量K2FeO4固体溶解水并等分为两份,置于不同温度的恒温水浴中,底部各放一张画有“+”字的白纸,观察记录看不到“+”字所需时间.
分析 (1)红棕色固体粉末1.60g是,物质的量是1.60g÷160g/mol=0.01mol,则根据铁元素守恒可知3.96 g化合物A中含有Fe元素的物质的量为0.02mol.将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g,该物质是硫酸钾,物质的量是10.44g÷174g/mol=0.06mol,则钾离子的物质的量是0.12mol,其中有0.08mol是氢氧化钾中的钾离子,因此3.96 g化合物A中含有钾元素的物质的量为0.04mol.则根据质量守恒可知氧元素的物质的量是$\frac{3.96g---0.02mol×56g/mol-0.04mol×39g/mol}{16g/mol}=0.08mol$,则K、Fe、O三种元素的个数之比是2:1:4,所以化合物A的化学式为K2FeO4.
(2)A在水溶液中不稳定,一段时间后转化为红褐色沉淀,这说明反应中有氢氧化铁生成;
(3)由于高铁酸钾溶于水能分解生成氢氧化铁红褐色测定,因此探究温度对化合物A水溶液稳定性的影响实验方案可设计为将适量K2FeO4固体溶解水并等分为两份,然后做对比实验.
解答 解:(1)红棕色固体粉末1.60g是,物质的量是1.60g÷160g/mol=0.01mol,则根据铁元素守恒可知3.96 g化合物A中含有Fe元素的物质的量为0.02mol.将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g,该物质是硫酸钾,物质的量是10.44g÷174g/mol=0.06mol,则钾离子的物质的量是0.12mol,其中有0.08mol是氢氧化钾中的钾离子,因此3.96 g化合物A中含有钾元素的物质的量为0.04mol.则根据质量守恒可知氧元素的物质的量是$\frac{3.96g---0.02mol×56g/mol-0.04mol×39g/mol}{16g/mol}=0.08mol$,则K、Fe、O三种元素的个数之比是2:1:4,所以化合物A的化学式为K2FeO4.
根据以上分析,3.96g化合物A中含有Fe元素的物质的量为0.02mol,含有钾元素的物质的量为0.04mol.化合物A的化学式为K2FeO4;
故答案为:0.02;0.04;K2FeO4;
(2)由上述分析可知,A的化学式为:K2FeO4,高铁酸钾与水反应生成氧气和Fe(OH)3、氢氧化钾,反应方程式为4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑,离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-,
故答案为:4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
(3)其方法为:将适量K2FeO4固体溶解水并等分为两份,置于不同温度的恒温水浴中,底部各放一张画有“+”字的白纸,观察记录看不到“+”字所需时间,
故答案为:将适量K2FeO4固体溶解水并等分为两份,置于不同温度的恒温水浴中,底部各放一张画有“+”字的白纸,观察记录看不到“+”字所需时间.
点评 本题考查无机物推断,属于计算型推断,综合考查学生阅读题目获取信息的能力、计算能力、设计实验能力等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,题目难度中等.

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | 1molSO2(g)的能量总和大于lmolS(s)和lmolO2(g)的能量总和 | |
| B. | 将2molSO2(g)与lmolO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16kJ | |
| D. | 当lmolS(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
| A. | 温度一定,一个化学反应的平衡常数是一个常数 | |
| B. | 两种物质反应,不管怎样书写化学方程式,平衡常数不变 | |
| C. | 温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 | |
| D. | 浓度商Qc<Kc,v(正)<v(逆) |
①称取样品;②用蒸馏水溶解样品;③过滤;④在烘箱中烘干沉淀;
⑤向溶液中加过量的用盐酸酸化的BaCl2溶液;⑥用蒸馏水洗涤沉淀并再用AgNO3溶液检验,不出现沉淀为止;⑦准确称量干燥沉淀的质量;⑧在干燥器中冷却;⑨计算.
| A. | ①②③⑥⑤④⑧⑦⑨ | B. | ①②⑤③⑥④⑧⑦⑨ | C. | ①②③④⑤⑧⑥⑦⑨ | D. | ①②③⑤⑥④⑧⑦⑨ |

| A. | 若I中装过量高锰酸钾溶液,Ⅱ中装澄清石灰水,则能检验SO2中是否混有CO2 | |
| B. | 若I中装足量澄清石灰水,Ⅱ中装浓硫酸,则能测定CO2和水蒸气的混合气体中水蒸气的含量 | |
| C. | 若I中装足量饱和碳酸钠溶液,Ⅱ中装浓硫酸,则能除去CO2中混有的HCl | |
| D. | 若I中装BaCl2溶液,Ⅱ中装水,则能证明SO2和NO2混合气体中SO2不与BaCl2反应 |
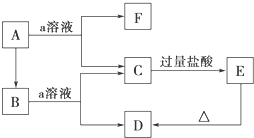
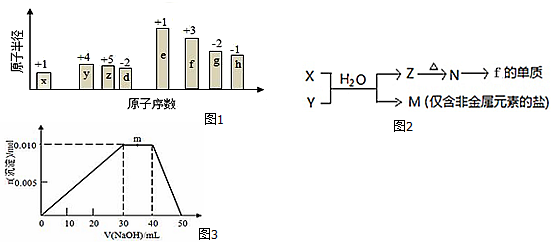
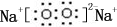 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号) 呵护生存环境,共建和谐社会是当今社会的主题.
呵护生存环境,共建和谐社会是当今社会的主题.