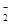题目内容
 1L某混合溶液.可能含有的离子如下表:
1L某混合溶液.可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
- A.该溶液中确定含有的离子有:H+、NH4+、Al3+
- B.肯定不存在的阴离子有:I-、ClO-、AlO2-
- C.不能确定是否含有的阳离子有:K+
- D.溶液中含有的Al3+和NH4+的物质的量之比为1:2
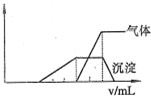
分析:根据产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,刚加入氢氧化钠溶液时,没有产生沉淀;之后产生了沉淀,且沉淀完全溶解;沉淀溶解前产生了气体,该气体一定是氨气;
以上分析依据,分别对离子存在情况作出判断.
解答:根据图示,开始时没有沉淀生成,说明溶液中氢离子,一定没有ClO-、AlO2-;随后出现沉淀,且沉淀完全溶解了,说明沉淀是氢氧化铝,溶液中一定含有铝离子,一定没有AlO2-,;氢氧化铝溶解前生成了气体,该气体一定是氨气,故溶液中一定含有铵离子;
A、该溶液中确定含有的离子有H+、NH4+、Al3+,故A正确;
B、一定不存在ClO-、AlO2-,不能确定I-,故B错误;
C、不能确定的有Cl-、Br-、I-、和K+,故C正确;
D、根据图示,溶解氢氧化铝消耗了氢氧化钠溶液体积是生成氨气消耗氢氧化钠溶液体积的一半,故溶液中含有的Al3+和NH4+的物质的量之比为1:2,故D正确;
故选B.
点评:本题是离子推断题,考查离子的检验方法及图示理解、分析能力,难度适中.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案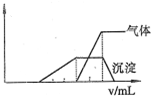 1L某混合溶液.可能含有的离子如下表: 1L某混合溶液.可能含有的离子如下表:
|
(13分)1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为 。
(3)V1、V2、 V3、 V4之间的关系 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
(10分) 1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO |
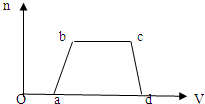
⑴ 往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)
与加入NaOH溶液的体积(V)的关系如右图所示。
则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为 。
(3)V1 、V2、V3、 V4之间的关系 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,
分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
 、Fe2+、Fe3+
、Fe2+、Fe3+