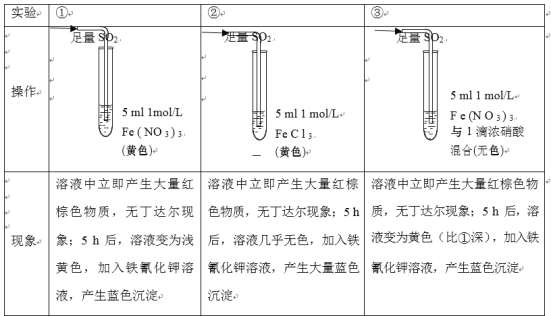
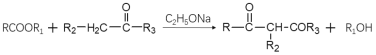
题目内容
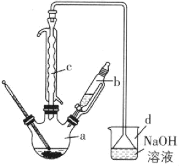
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
物质 | 苯 | 溴 | 溴苯 |
密度/(g·cm-3) | 0.88 | 3.12 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解性 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了___气体。继续滴加至液溴滴完。装置d的作用是___。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是___。
③向分液分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为___。要进一步提纯,下列操作合理的是___(填序号)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是___(填序号)。
A.25mL B.50mL C.250mL D.509mL
【答案】HBr 吸收HBr和Br2 除去HBr和未反应的Br2 干燥粗溴苯 苯 C B
【解析】
a中,Fe和溴发生氧化反应生成溴化铁,在溴化铁作催化剂条件下,苯和溴发生取代反应生成溴苯和HBr,HBr遇水蒸气生成氢溴酸小液滴而产生白雾,冷凝管有冷凝回流作用,提高反应物的利用率;生成的HBr和挥发出的溴通过导气管进入d中和氢氧化钠反应生成钠盐,结合溴苯的性质分析解答。
(1)苯与液溴发生取代反应生成溴苯和溴化氢,溴化氢极易吸收空气中的水蒸气形成小液滴,故装置a中有白色烟雾产生;装置d中装有的氢氧化钠溶液可以吸收HBr和Br2,故答案为:HBr;吸收HBr和Br2;
(2)②溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,把HBr及未反应的Br2变成NaBr和NaBrO洗到水中,故答案为:除去HBr和未反应的Br2;
③无水氯化钙作干燥剂,加入无水氯化钙的目的是干燥粗溴苯,故答案为:干燥粗溴苯;
(3)苯与溴苯互溶,经过水和氢氧化钠溶液洗涤后,无法除去苯,所以粗溴苯中还含有的主要杂质为苯;苯与溴苯互溶,可以根据苯与溴苯的沸点不同,用蒸馏法分离,故答案为:C。
(4)根据题意,在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,液溴滴完后,又向a中加入10mL水,此时a中液体总体积接近30mL,所以a的容积最适合的是50mL,故答案为:B。

【题目】800℃时,在2L恒容密闭容器中投入0.20molNO和0.12mol O2发生下列反应2NO(g)+O2(g) ![]() 2NO2(g),n(NO)随时间的变化情况如下表:
2NO2(g),n(NO)随时间的变化情况如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.04 | 0.04 |
(1)800℃时,该反应平衡时的NO的物质的量浓度为______;升高温度,NO的平衡浓度为0.03molL-1,则该反应为_______反应(填“放热”或“吸热”)。
(2)用O2表示0~2s内该反应的平均反应速率v(O2)=______。
(3)能说明该反应一定达到平衡状态的是______。
a v(NO2)=2v(O2) b 容器内压强保持不变
c 容器内气体颜色保持不变 d 容器内气体密度保持不变
(4) 平衡后,下列措施能使该反应向正反应方向移动,且正反应速率增大的是____。
a 适当升高温度 b 适当降低温度
c 增大O2的浓度 d 选择高效催化剂
(5)800℃时,上述反应的平衡常数K=______,若容器中含1.00 molL-1 NO、2.00 molL-1O2和2.00 molL-1 NO2,则此时v正_______v逆 (填“>”、“<”或“=”)。
【题目】已知常温下,3种物质的电离平衡常数如下表:
物质 | HCOOH | CH3COOH | NH3·H2O |
电离平衡常数K | 1.77×104 | 1.75×105 | 1.76×105 |
下列说法不正确的是
A.等物质的量浓度时,溶液pH:HCOONa<CH3COONa
B.pH均为3时,溶液浓度:c(HCOOH)>c(CH3COOH)
C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+)
D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7