题目内容
20.氧气的摩尔质量是( )| A. | 16 g | B. | 32 g | C. | 32 g/mol | D. | 32 |
分析 摩尔质量是指单位物质的量的物质所具有的质量,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量;据此分析计算即可.
解答 解:摩尔质量是指单位物质的量的物质所具有的质量,氧气的相对分子质量是16×2=32,故氧气的摩尔质量是32g/mol.
故选C.
点评 本题难度不大,掌握摩尔质量的计算方法、单位是g/mol是正确解答本题的关键.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
10. 已知 25℃时部分弱电解质的电离平衡常数数据如表:
已知 25℃时部分弱电解质的电离平衡常数数据如表:
回答下列问题:
(1)写出碳酸的主要的电离方程式H2CO3?H++HCO3-.若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+)大于原来的十分之一(填“大于”、“小于”或“等于”).
(2)物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为e<a<d<c<b(用编号填写).
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3 e.NaSCN
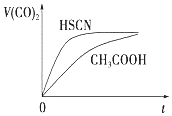
(3)25℃时,将 20mL0.1mol•L-1CH COOH 溶液和 20mL0.1mol•L-1HSCN 溶液分别与 20mL0.1mol•L-1NaHCO 溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图.反应初始阶段两种溶液产生 CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快反应结束后,假设 NaHCO3完全反应且气体全部逸出,则所得两溶液中,c(CH3COO)<c(SCN)(填“>”、“<”或“=”)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)-c(CH3COO-)=10-6-10-8mol/L(填代入数据后的计算式,不必算出具体数值).
(5)向 NaClO 溶液中通入少量的 CO2,发生反应的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
 已知 25℃时部分弱电解质的电离平衡常数数据如表:
已知 25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | Ka1=4.3×10-1Ka2=5.6×10-1 | 3.0×10-8 |
(1)写出碳酸的主要的电离方程式H2CO3?H++HCO3-.若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+)大于原来的十分之一(填“大于”、“小于”或“等于”).
(2)物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为e<a<d<c<b(用编号填写).
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3 e.NaSCN
(3)25℃时,将 20mL0.1mol•L-1CH COOH 溶液和 20mL0.1mol•L-1HSCN 溶液分别与 20mL0.1mol•L-1NaHCO 溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图.反应初始阶段两种溶液产生 CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快反应结束后,假设 NaHCO3完全反应且气体全部逸出,则所得两溶液中,c(CH3COO)<c(SCN)(填“>”、“<”或“=”)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)-c(CH3COO-)=10-6-10-8mol/L(填代入数据后的计算式,不必算出具体数值).
(5)向 NaClO 溶液中通入少量的 CO2,发生反应的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
11.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 比较水和乙醇中氢的活泼性 | 分别讲少量钠投入到盛有水和乙醇的烧杯中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和的FeCl3溶液中 |
| A. | A | B. | B | C. | C | D. | D |
8.相同物质的量的SO2和SO3相比较,下列叙述正确的是( )
①分子数之比为1:1
②所含O原子数之比为2:3
③原子总数之比为3:4
④S原子数之比为1:1
⑤质子数之比4:5.
①分子数之比为1:1
②所含O原子数之比为2:3
③原子总数之比为3:4
④S原子数之比为1:1
⑤质子数之比4:5.
| A. | ①⑤ | B. | ②③ | C. | ①②③④⑤ | D. | ①②③④ |
15.某广告称某种牌号的八宝粥(含桂圆、红豆、糯米等)不加糖,比加糖还甜,最适合糖尿病人食用.你认为下列关于糖尿病人能否食用此八宝粥的判断正确的是( )
| A. | 这个广告有误导喜爱甜食的消费者的嫌疑,不加糖不等于没有糖 | |
| B. | 不加糖不等于没有糖,糖尿病人食用需慎重 | |
| C. | 不能只听从厂商或广告商的宣传,应咨询医生 | |
| D. | 糖尿病人应少吃含糖的食品.该八宝粥未加糖,可以放心食用 |
5.物质的量符号为( )
| A. | M | B. | m | C. | n | D. | V |
12.下列反应的离子方程式书写正确的是( )
| A. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| B. | 硅酸钠与稀硫酸反应:Na2SiO3+2H+═2Na++H2SiO3↓ | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O |
9.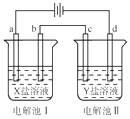 如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
 如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| 选项 | X | Y |
| A | MgSO4 | CuSO4 |
| B | CuSO4 | AgNO3 |
| C | FeSO4 | Al2(SO4)3 |
| D | AgNO3 | Pb(NO3)2 |
| A. | A | B. | B | C. | C | D. | D |