题目内容
20.某气体的摩尔质量为M g/mol,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X.则$\frac{MX}{V{N}_{A}}$表示的是( )| A. | V L该气体的质量(以g为单位) | B. | 1 L该气体的质量(以g为单位) | ||
| C. | 1 mol该气体的体积(以L为单位) | D. | 1 L该气体的物质的量(以mol为单位) |
分析 根据题给条件,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X,则气体物质的量n=$\frac{x}{{N}_{A}}$mol,乘以气体摩尔质量得到气体的质量,再除以气体体积得到的是气体的密度.
解答 解:A、以g为单位VL,该气体的质量为:n=$\frac{x}{{N}_{A}}$mol×M g•mol-1,故A错误;
B、以g为单位1L该气体的质量即气体的密度=$\frac{x}{{N}_{A}}$mol×M g•mol-1/VL=$\frac{MX}{V{N}_{A}}$,故B正确;
C、该气体的物质的量为:n=$\frac{x}{{N}_{A}}$mol,体积为V L,1mol该气体的体积是$\frac{V{N}_{A}}{x}$,故C错误;
D、由于V L的该气体所含有的分子数为X,故1L气体中含有的分子数为$\frac{x}{V}$个,则物质的量为$\frac{\frac{x}{V}}{{N}_{A}}$=$\frac{x}{V{N}_{A}}$mol,故D错误.
故选B.
点评 本题考查了物质的量与微粒数、质量、摩尔质量、气体体积、阿伏伽德罗常数等物理量之间的关系和计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.以下物质间的每步转化中,不能通过一步反应实现的是( )
| A. | Fe→Fe2O3→Fe(OH)3 | B. | SO2→SO3→H2SO4 | ||
| C. | FeCl2→Fe(OH)2→Fe(OH)3 | D. | NO→NO2→HON3 |
8.丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法正确的是( )


| A. | 丹参素在C上取代H的一氯代物有4种 | |
| B. | 在Ni催化下1mol丹参素最多可与4molH2加成 | |
| C. | 丹参素能发生取代、消去、中和、氧化等反应 | |
| D. | 1mol丹参素在一定条件下与足量金属钠反应可生成4molH2 |
15.金属能导电的原因是( )
| A. | 金属阳离子与自由电子间的作用较弱 | |
| B. | 金属在外加电场作用下可失去电子 | |
| C. | 金属阳离子在外加电场作用下可发生定向移动 | |
| D. | 自由电子在外加电场作用下可发生定向移动 |
5.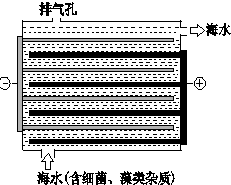 海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.
(1)氯原子结构示意图是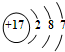 ,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).
,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).
(2)向浓缩的海水中通入Cl2,可将Br-转化为Br2.再用“空气吹出法”将Br2从浓海水中吹出,并用纯碱浓溶液吸收,生成NaBr、NaBrO3等.当有1mol Br2被纯碱吸收时,转移的电子数为1×1024.
(3)如图是NaClO的发生装置.该装置主要利用了电解饱和食盐水的原理,可实现对海水的消毒和灭藻.
①写出装置中产生NaClO的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,2NaOH+Cl2→NaClO+NaCl+H2O.
海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3.生成CaCO3的离子方程式是Ca2++HCO3-+OH-→CaCO3↓+H2O.
若每隔5-10min倒换一次电极电性,可有效地解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e→Cl2↑,产生的氯气与水发生反应:Cl2+H2=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.
NaOH溶液吸收SO2得Na2SO3,可用Na2SO3吸收SO2.在SO2被吸收的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下:
②从上表可判断,NaHSO3溶液呈酸性(填“酸性”、“碱性”、“中性”),请用平衡原理解释:HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
③当吸收液呈中性时,溶液中离子浓度关系正确的是ab(选填字母).
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
d.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)=c(OH-)
 海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.(1)氯原子结构示意图是
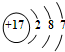 ,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).
,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).(2)向浓缩的海水中通入Cl2,可将Br-转化为Br2.再用“空气吹出法”将Br2从浓海水中吹出,并用纯碱浓溶液吸收,生成NaBr、NaBrO3等.当有1mol Br2被纯碱吸收时,转移的电子数为1×1024.
(3)如图是NaClO的发生装置.该装置主要利用了电解饱和食盐水的原理,可实现对海水的消毒和灭藻.
①写出装置中产生NaClO的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,2NaOH+Cl2→NaClO+NaCl+H2O.
海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3.生成CaCO3的离子方程式是Ca2++HCO3-+OH-→CaCO3↓+H2O.
若每隔5-10min倒换一次电极电性,可有效地解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e→Cl2↑,产生的氯气与水发生反应:Cl2+H2=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.
NaOH溶液吸收SO2得Na2SO3,可用Na2SO3吸收SO2.在SO2被吸收的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
③当吸收液呈中性时,溶液中离子浓度关系正确的是ab(选填字母).
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
d.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)=c(OH-)
12.在农业上,尿素CO(NH2)2、NH4NO3、NH4HCO3、(NH4)2CO3都可以做氮肥使用.在这四种物质中,氮的质量分数最高的是( )
| A. | 尿素CO(NH2)2 | B. | NH4NO3 | C. | NH4HCO3 | D. | (NH4)2CO3 |
9.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H+) | |
| B. | 使红色布条褪色(Cl2) | |
| C. | 氯水能够导电(ClO) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
