题目内容
 某学生利用如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
某学生利用如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.请回答下列问题:
(1)装置F中发生反应的离子方程式为
(2)装置A的烧瓶中可装试剂为
(3)B装置的名称是
(4)通入C装置的两根导管左边较长、右边较短,目的是
(5)装置c内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
考点:性质实验方案的设计,氨的制取和性质
专题:实验题
分析:(1)二氧化锰可以和浓盐酸在加热条件下生成氯气,浓盐酸中的氯化氢在离子方程式中需要拆开,据此写出反应的离子方程式;
(2)浓氨水可以和生石灰或烧碱或碱石灰等物质在不加热条件下反应生成氨气;
(3)装置B为球形干燥管,饱和食盐水可以除去氯气中的氯化氢杂质;
(4)根据气体的密度大小结合导管的长度来考虑气体之间混合的充分程度;根据阿伏伽德罗常数NA=
计算;
(5)氨气和氯气反应生成氯化铵和氮气;
(6)氯气能够与碱性试剂反应,据此判断尾气中氯气的正确处理方法.
(2)浓氨水可以和生石灰或烧碱或碱石灰等物质在不加热条件下反应生成氨气;
(3)装置B为球形干燥管,饱和食盐水可以除去氯气中的氯化氢杂质;
(4)根据气体的密度大小结合导管的长度来考虑气体之间混合的充分程度;根据阿伏伽德罗常数NA=
| N |
| n |
(5)氨气和氯气反应生成氯化铵和氮气;
(6)氯气能够与碱性试剂反应,据此判断尾气中氯气的正确处理方法.
解答:
解:(1)二氧化锰可以和浓盐酸在加热条件下生成氯气,反应的离子方程式为:MnO2+4H++2Cl-
Cl2↑+Mn2++2H2O,
故答案为:MnO2+4H++2Cl-
Cl2↑+Mn2++2H2O;
(2)浓氨水可以和生石灰或烧碱或碱石灰等具有吸水性的物质在不加热条件下反应生成氨气,
故答案为:生石灰(或烧碱或碱石灰);
(3)根据图示装置可知,B装置的名称为球形干燥管,其盛放的碱石灰用于干燥氨气;氯气在饱和食盐水中溶解度较小,所以E装置中,可以用饱和食盐水除去氯气中的氯化氢杂质,
故答案为:球形干燥管;除去氯气中的氯化氢;
(4)氨气的密度小,氯气的密度更大,C装置的两导管左边长、右边短,这样便于两种气体充分接触而反应,
故答案为:因为氨气的密度小,氯气的密度更大,这样便于两种气体充分接触而反应;
(5)氨气和氯气反应生成白烟氯化铵和空气的主要成分之一氮气,即8NH3+3Cl2═6NH4Cl+N2;根据反应可知,1mol氯气完全反应转移了2mol电子,则a mol氯气反应,转移的电子为2a mol,而电子总数为b个,则阿伏伽德罗常数为:NA=
,
故答案为:8NH3+3Cl2═6NH4Cl+N2;
;
(6)氯气是酸性气体,可以用氢氧化钠来进行尾气处理,或者是通入装有碱石灰的干燥管或气球收集,
故答案为:将尾气通入NaOH溶液中或通入装有碱石灰的干燥管或气球收集等.
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)浓氨水可以和生石灰或烧碱或碱石灰等具有吸水性的物质在不加热条件下反应生成氨气,
故答案为:生石灰(或烧碱或碱石灰);
(3)根据图示装置可知,B装置的名称为球形干燥管,其盛放的碱石灰用于干燥氨气;氯气在饱和食盐水中溶解度较小,所以E装置中,可以用饱和食盐水除去氯气中的氯化氢杂质,
故答案为:球形干燥管;除去氯气中的氯化氢;
(4)氨气的密度小,氯气的密度更大,C装置的两导管左边长、右边短,这样便于两种气体充分接触而反应,
故答案为:因为氨气的密度小,氯气的密度更大,这样便于两种气体充分接触而反应;
(5)氨气和氯气反应生成白烟氯化铵和空气的主要成分之一氮气,即8NH3+3Cl2═6NH4Cl+N2;根据反应可知,1mol氯气完全反应转移了2mol电子,则a mol氯气反应,转移的电子为2a mol,而电子总数为b个,则阿伏伽德罗常数为:NA=
| b |
| 2a |
故答案为:8NH3+3Cl2═6NH4Cl+N2;
| b |
| 2a |
(6)氯气是酸性气体,可以用氢氧化钠来进行尾气处理,或者是通入装有碱石灰的干燥管或气球收集,
故答案为:将尾气通入NaOH溶液中或通入装有碱石灰的干燥管或气球收集等.
点评:本题考查实验室氯气、氨气的制备、氧化还原反应的有关计算等知识,该题是高考中的常见题型和重要的考点,属于基础性试题的考查,侧重对学生能力的培养和解题方法的指导和训练;该题的关键是准确判断出有关元素的化合价变化情况,并结合电子的得失守恒进行计算即可,试题有利于培养学生的化学实验、化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
小科为研究“碱与盐反应”的规律,设计了如图所示的五组实验,每支试管盛有3毫升溶液,分别向试管中滴加3滴溶液,除氢氧化钙溶液是饱和外,其余溶液的质量分数都为5%,下列叙述正确的是( )


| A、甲组和乙组实验能观察到相同的现象 |
| B、乙组和丙组实验均能观察到蓝色沉淀 |
| C、乙组实验产生的沉淀质量比丁组多 |
| D、戊组实验产生的沉淀质量比丙组少 |
在恒温时,一固定容积的容器内发生反应:PCl5(g)?PCl3 (g)+Cl2(g).达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度( )
| A、增大 | B、减小 |
| C、不变 | D、无法判断 |
如图表示在催化剂作用下将X和Y合成具有生物活性物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述正确的是( )
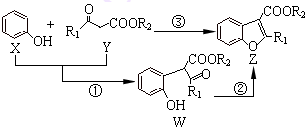

| A、反应①属于加成反应 |
| B、W中至少含有1个手性碳原子 |
| C、X、Y、W、Z这四种物质中最多有三种能与NaOH溶液反应 |
| D、可用溴水或FeCl3溶液鉴别出X和W |


 和环状结构
和环状结构 是E的最简单的同系物.
是E的最简单的同系物.


