题目内容
19.相关数据如表:| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
| A. | △H=+102kJ/mol | B. | △H=-102kJ/mol | C. | △H=+267kJ/mol | D. | △H=-267kJ/mol |
分析 1molH2(g)化学键断裂时需要吸收的能量为436kJ,1molBr2(g)化学键断裂时需要吸收的能量为200kJ,1molHBr(g)化学键断裂时需要吸收的能量为369kJ,依据△H=反应物的总键能-生成物的总键能列方程计算.
解答 解:1molH2(g)化学键断裂时需要吸收的能量为436kJ,1molBr2(g)化学键断裂时需要吸收的能量为200kJ,1molHBr(g)化学键断裂时需要吸收的能量为369kJ,H2(g)+Br2(g)═2HBr(g)△H=-102kJ•mol-1,依据△H=反应物的总键能-生成物的总键能,则△H=436+200-369×2=-102kJ/mol,
故选B.
点评 本题考查反应热的计算,题目难度不大,注意反应热与键能的计算关系,明确△H=反应物的总键能-生成物的总键能是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.中国环境监测数据显示,颗粒物(PM2.5等)为雾霾过程中影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气.
(1)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(2)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H,得到两组数据
该反应的△H<0(填“<”或“>”);若在7500C时,另做一组实验,在2L的恒容密闭容器中加入lmol CO,3mo1H2O,2mo1CO2,5mol H2,则此时?正<?逆(填“<”,“>”,“=”).
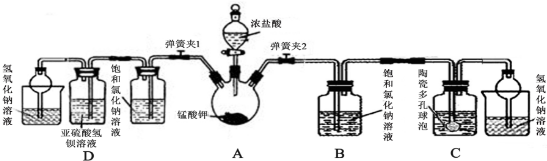
(3)一定条件下,某密闭容器中已建立A(g)+B(g)?C(g)+D(g)△H>0的化学平衡,其时间速率图象如图1,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是A
A.减小压强,同时升高温度,平衡正向移动
B.增加A(g)浓度,同时降低温度,平衡不移动
C.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+2NO2(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H2<0
(4)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO):V (NO2)=1:1.
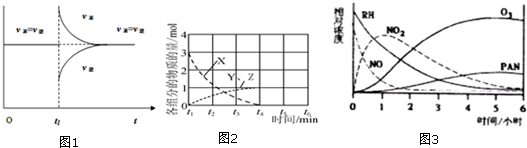
(5)在不同条件下,NO的分解产物不同.在高压下,NO(即X)在40℃下分解生成两种化合物(即Y、Z),体系中各组分物质的量随时间变化曲线如图2所示.写出Y和Z的化学式:N2O、NO2
(6)某研究性学习小组,为研究光化学烟雾消长
规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于图3,根据图中数据,下列推论,最不合理的是D
A.NO的消失的速率比RH快
B.NO生成NO2
C.RH及NO2可以生成PAN及O3
D.O3生成PAN
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气.
(1)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(2)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H,得到两组数据
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
(3)一定条件下,某密闭容器中已建立A(g)+B(g)?C(g)+D(g)△H>0的化学平衡,其时间速率图象如图1,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是A
A.减小压强,同时升高温度,平衡正向移动
B.增加A(g)浓度,同时降低温度,平衡不移动
C.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+2NO2(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H2<0
(4)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO):V (NO2)=1:1.
(5)在不同条件下,NO的分解产物不同.在高压下,NO(即X)在40℃下分解生成两种化合物(即Y、Z),体系中各组分物质的量随时间变化曲线如图2所示.写出Y和Z的化学式:N2O、NO2
(6)某研究性学习小组,为研究光化学烟雾消长
规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于图3,根据图中数据,下列推论,最不合理的是D
A.NO的消失的速率比RH快
B.NO生成NO2
C.RH及NO2可以生成PAN及O3
D.O3生成PAN

10.当航天飞机返回地球进入大气层时,由于空气的剧烈磨擦,航天飞机尖端的温度可达1000℃以上.为了防止极高的温度将其烧毁,科学家给航天飞机相应部位设计安装了可靠的保护层.制作保护层的材料可能为( )
| A. | 合成塑料 | B. | 合成纤维 | C. | 镁铝合金 | D. | 新型陶瓷 |
7.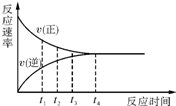 一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随时间的变化如图所示,下列判断正确的是( )
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随时间的变化如图所示,下列判断正确的是( )
 一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随时间的变化如图所示,下列判断正确的是( )
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随时间的变化如图所示,下列判断正确的是( )| A. | t1时刻,v(正)<v(逆) | B. | t2时刻,v(正)>v(逆) | C. | t3时刻,v(正)=v(逆) | D. | t4时刻,v(正)<v(逆) |
14.根据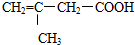 的结构,它不可能发生的反应是( )
的结构,它不可能发生的反应是( )
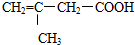 的结构,它不可能发生的反应是( )
的结构,它不可能发生的反应是( )| A. | 与银氨溶液反应析出银 | |
| B. | 使溴的四氯化碳溶液褪色 | |
| C. | 与乙醇在浓硫酸催化下发生酯化反应 | |
| D. | 与新制氢氧化铜反应 |
4.下列有关说法中正确的是( )
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
2.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:
(1)下列有关滴定操作的顺序正确的是B
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④B.③⑤①②④C.③⑤②①④D.②①③⑤④
(2)用标准的盐酸滴定待测的NaOH溶液时,一手握酸式滴定管的活塞,一手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,本实验滴定达到终点的标志是溶液颜色由黄色突变为橙色,且半分钟内不变色
(3)下列哪些操作会使测定结果偏高ABC
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后未用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数仰视滴定管读数,滴定后俯视滴定管读数
(4)某学生根据3次实验分别记录有关数据如下表:
则该NaOH溶液的物质的量浓度为0.1112mol/L.
(1)下列有关滴定操作的顺序正确的是B
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④B.③⑤①②④C.③⑤②①④D.②①③⑤④
(2)用标准的盐酸滴定待测的NaOH溶液时,一手握酸式滴定管的活塞,一手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,本实验滴定达到终点的标志是溶液颜色由黄色突变为橙色,且半分钟内不变色
(3)下列哪些操作会使测定结果偏高ABC
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后未用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数仰视滴定管读数,滴定后俯视滴定管读数
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 22.20 |
| 第二次 | 20.00 | 1.56 | 25.50 |
| 第三次 | 20.00 | 0.22 | 22.48 |
19.下列各组气体,在通常条件下能稳定共存的是( )
| A. | NH3、O2、HCl | B. | N2、H2、HCl | C. | CO2、NO、O2 | D. | H2S、O2、SO2 |