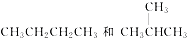题目内容
下列叙述错误的是( )
| A、锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解除去 |
| B、向沸水中滴加FeCl3饱和溶液制各Fe(OH)3胶体的原理是加热促进了Fe3+水解 |
| C、向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 |
| D、胶体区别于其它分散系的本质特征是分散质微粒直径在1 nm~100 nm之间 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,胶体的重要性质,电解质在水溶液中的电离,盐类水解的应用
专题:
分析:A、CaCO3的溶解度小于CaSO4,根据沉淀的转化来分析;
B、加热促进了的Fe3+水解;
C、水的离子积大小和温度有关,酸碱会抑制水的电离;
D、胶体区别于其他分散系的本质特征是分散质的微粒直径大小;
B、加热促进了的Fe3+水解;
C、水的离子积大小和温度有关,酸碱会抑制水的电离;
D、胶体区别于其他分散系的本质特征是分散质的微粒直径大小;
解答:
解:A、CaCO3的溶解度小于CaSO4,故CaSO4用饱和Na2CO3溶液浸泡可转化为溶解度更小的CaCO3,然后再用稀盐酸溶解除去,故A正确.
B、向沸水中滴加FeCl3饱和溶液制各Fe(OH)3胶体的原因是加热促进的Fe3+水解,故B正确;
C、向纯水中加入盐酸会抑制水的电离,但是离子积不变,降温都能使水的离子积减小,故C错误;
D、胶体区别于其他分散系的本质特征是分散质的微粒直径大小,胶体分散系的微粒直径在1~100nm之间,故D正确;
故选C.
B、向沸水中滴加FeCl3饱和溶液制各Fe(OH)3胶体的原因是加热促进的Fe3+水解,故B正确;
C、向纯水中加入盐酸会抑制水的电离,但是离子积不变,降温都能使水的离子积减小,故C错误;
D、胶体区别于其他分散系的本质特征是分散质的微粒直径大小,胶体分散系的微粒直径在1~100nm之间,故D正确;
故选C.
点评:本题考查沉淀的转化、胶体的制备和胶体的性质,难度不大,注意胶体区别于其他分散系的本质特征是分散质的微粒直径大小.

练习册系列答案
相关题目
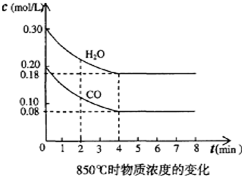 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度变化如图,下列叙述错误的是( )
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度变化如图,下列叙述错误的是( )| A、0一4min的平均反应速率υ(CO2)为0.03mol/(L?min) |
| B、850℃时,平衡常数K=1 |
| C、850℃时,若向该容器中充入1.0 mol CO、1.0 molH2O,则CO的平衡转化率不变 |
| D、容器中气体密度不变不能判断该反应已经达到化学平衡状态 |
今有HA、H2B两种弱酸,有如下关系:H2B+A-=HB-+HA,B2-+HA=HB-+A-,则下列说法正确的是( )
| A、H2B的电离方程式为:H2B?2H++B2- |
| B、结合质子能力由强到弱的顺序为:B2->A->HB-C |
| C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强 |
| D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者 |
下列关于钠的化合物的说法中,正确的是( )
| A、分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,出现的现象不相同 |
| B、NaHCO3固体中含有的Na2CO3可用加热的方法除去 |
| C、Na2O2和Na2O均为白色固体,与CO2反应均放出O2 |
| D、Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 |
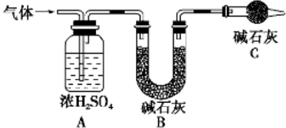 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物