题目内容
水的电离过程为H2O H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随温度的升高而降低
B.35℃时,c(H+)>c(OH-)
C.溶液:pH(35℃)>pH(25℃)
D.水的电离是吸热的过程
 阅读快车系列答案
阅读快车系列答案25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 mol·L-1 | K1=4.4×10-7 mol·L-1 K2=5.6×10-11 mol·L-1- | 3.0×10-8mol·L-1 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+)
B.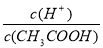
C.c(H+)·c(OH-)
D.
E.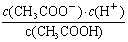
若该溶液升高温度,上述5种表达式的数据增大的是___________。
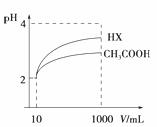
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。稀释后,HX溶液中由水电离出来的c(H+) __________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是______________________________。
(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显__________(填“酸”、“碱”或“中”)性。将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=__________。


 中n值为( )
中n值为( )

 O2(g)=H2O(l) ΔH3=―285.8kJ/mol,则由石墨生成甲烷的反应热:
O2(g)=H2O(l) ΔH3=―285.8kJ/mol,则由石墨生成甲烷的反应热: R(气)+2L(?)此反应符合下面图象,下列叙述正确的是
R(气)+2L(?)此反应符合下面图象,下列叙述正确的是
