题目内容
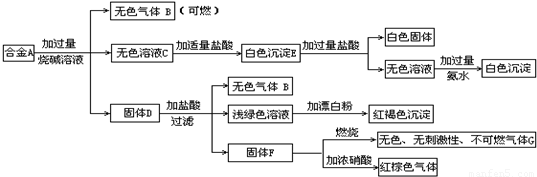
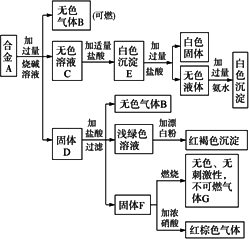
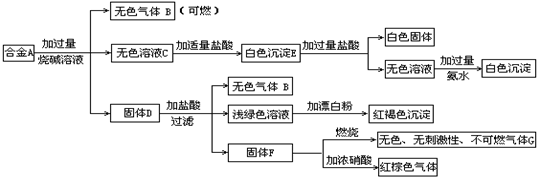
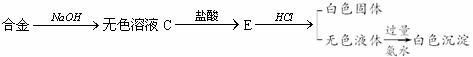
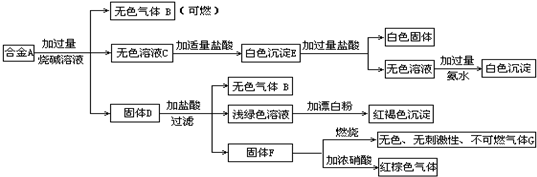
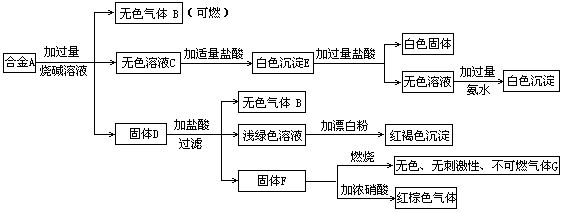
现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生的反应如图所示.
试填写下列空白:
(1)A中所含单质为________(写化学式).
(2)写出A中能与烧碱溶液反应的离子方程式________.
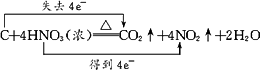
(3)写出固体F与浓硝酸反应的化学方程式,并标出电子转移的方向和数目,指出氧化产物________.
答案:
解析:
解析:
|
答案:(1)Fe、Al、Si、C (2)2Al+2OH-+6H2O Si+2OH-+H2O (3)
氧化产物:CO2 解析:由所给框图中的 合金 可判断其中含有Al和Si,上述白色固体为H2SiO3,白色沉淀E为Al(OH)3和H2SiO3的混合物,最终白色沉淀为Al(OH)3. 由固体D发生的一系列反应,从浅绿色溶液和红褐色沉淀突破,D中应有Fe;由F对应关系,判断F为C.故合金中所含单质为Al、Si、Fe、C. |

练习册系列答案
相关题目


 填写下列空白:
填写下列空白: