题目内容
已知:下图中B、G为常见金属单质,A、J为非金属气体单质,其余为常见物质或其水溶液,其中H为蓝色沉淀。B在A气体中燃烧产生棕色烟,I的焰色反应为黄色,F为无色气体,遇空气后变为红棕色。
回答下列问题:
(1)写出:①化学式D___________;②K物质的电子式___________;
(2)写出B与C反应的离子方程式______________________;
(3)1 molG与足量的水反应,生成还原产物的质量为___________g;
(4)以石墨为电极电解L溶液的化学方程式为___________,当电路中转移4mol电子时,可从阴极上收集到气体___________L(标准状况)。
(1)①CuCl2 ②![]()
(2)3Cu+![]() +8H+====3Cu2++2NO
+8H+====3Cu2++2NO![]() +4H2O
+4H2O
(3)1
![]()

(12分)工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
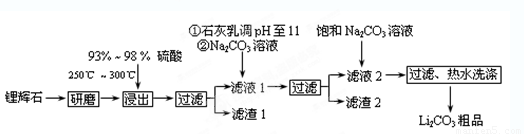
已知:① Li2O·Al2O3·4SiO2
+H2SO4(浓)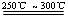 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示。
|
T/℃ |
20 |
40 |
60 |
80 |
|
S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中最佳反应的离子方程式是____________________________。
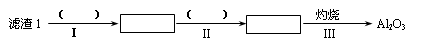
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)
__________________________________________________________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是______________________________________。
② b中,生成Li2CO3反应的化学方程式是______________________________。


