题目内容
如果用排水法收集浓硝酸受热分解所产生的气体,则
A.收集到NO B.收集到NO2 C.收集到O2 D.收集不到任何气体
D
【解析】
试题分析:硝酸分解的方程式为4HNO3(浓)△4NO2↑+O2↑+2H2O,收集到的气体是氧气和NO2,如果用排水法收集,则发生反应;4NO2+O2+2H2O=4HNO3,所以得不到任何气体,答案选D。
考点:考查硝酸分解反应的有关判断

已知:N2(g)+3H2(g) 2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
| H2(g) | N2(g) | NH3(g) |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,
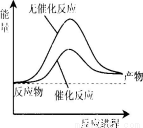
下列说法正确的是
A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO 3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。

装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
