题目内容
17.某无机盐M是一种优良的氧化剂,为确定其化学式,设计如图探究实验: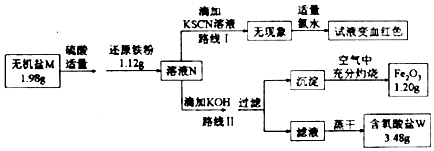
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其分子中的原子个数比为2:1:4;
②该小组同学将溶液N分为二等份,分别按路线I、路线II进行实验.每步部反应完全.
请按要求回答下列问题:
(1)由路线I的现象可知,溶液N中含有的阳离子是Fe2+.
(2)由实验流程图可推得.含氧酸盐W的化学式是K2SO4;由路线II可知,1.98g无机盐M中所含钾元素的质量为0.78g.
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O.
分析 1.2g氧化铁的物质的量为:$\frac{1.2g}{160g/mol}$=0.0075mol,则溶液N中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,故原来无机盐M中铁元素的物质的量为0.03mol-0.02mol=0.01mol;由转化关系可知W为K2SO4,3.48g K2SO4物质的量为0.02mol,故无机盐W中含钾元素,依据W为含氧酸根,且分子中的原子个数比为1:2:4,可得M的化学式为K2FeO4,
(1)路线Ⅰ为检验亚铁离子的方法;
(2)K2FeO4与稀硫酸、铁粉反应生成硫酸亚铁、硫酸钾和水,根据质量守恒可知W为硫酸钾;根据n=$\frac{m}{M}$计算出K2FeO4的物质的量,再根据n=nM计算出钾离子的质量;
(3)根据K2FeO4与稀硫酸、铁粉反应生成硫酸亚铁、硫酸钾和水写出反应的化学方程式.
解答 解:(1)根据路线Ⅰ可知,N溶液中一定含有亚铁离子,故答案为:Fe2+;
(2)1.2g氧化铁的物质的量为:$\frac{1.2g}{160g/mol}$=0.0075mol,则溶液中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,无机盐M分子中的原子个数比为1:2:4,则M的化学式为:K2FeO4,根据流程可知,K2FeO4与稀硫酸、还原铁粉反应生成硫酸亚铁和硫酸钾,根据质量守恒可知W为硫酸钾,1.98gK2FeO4的物质的量为$\frac{1.98g}{198g/mol}$=0.01mol,0.01molK2FeO4中含有0.02mol钾离子,含有钾离子的质量为39g/mol×0.02mol=0.78g,
故答案为:K2SO4 ;0.78;
(3)1.66gNa2FeO4的物质的量为0.01mol,1.12g还原铁粉的物质的量为0.02mol,所以Na2FeO4与还原铁粉按物质的量之比为1:2反应的化学反应方程为:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O,
故答案为:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O.
点评 本题考查了探究物质组成的方法,为高频考点,试题涉及物质组成的测定、浓硫酸的性质、离子方程式、化学方程式的书写、离子的检验方法等知识,试题知识点较多,综合性较强,充分考查了学生灵活应用基础知识的能力,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| 选项 | 操作和现象 | 结论 |
| A | 将少量溴水加入KI溶液中,充分反应后再加入CCl4,振荡,静置,下层液体呈紫色 | 氧化性:Br2>I2 |
| B | 常温下,打磨后的铝片放入HNO3中,无明显现象 | 常温下,铝不与浓HNO3反应 |
| C | 向一定量AgNO3溶液中,先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 用pH计测定NaF溶液和CH3COONa溶液可知:pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
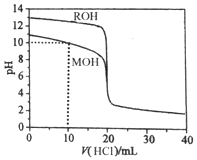
| A. | pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-) | |
| C. | 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-) | |
| D. | V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-) |
| A. | 钢铁腐蚀 | B. | 游泳池加漂白精消毒 | ||
| C. | 防毒面具中加Na2O2供氧 | D. | 纯碱去油污 |
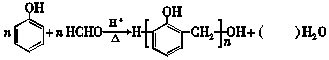
下列说法正确的是( )
| A. | 方程式中水的化学计量数是 2n-1 | |
| B. | 常温下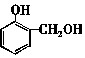 比 比 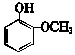 更难溶于水 更难溶于水 | |
| C. | 1 mol HCHO与银氨溶液反应最多可以生成2 mol Ag | |
| D. |  的单体是 的单体是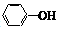 和HCHO 和HCHO |
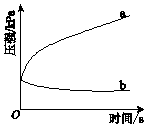 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )| A. | 两容器中负极反应均为Fe-2e-═Fe2+ | |
| B. | 曲线a记录的是pH=2的盐酸中压强的变化 | |
| C. | 曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH- | |
| D. | 在弱酸性溶液中,生铁能发生吸氧腐蚀 |
| A. | 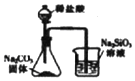 如图用于证明非金属性强弱:Cl>C>S | |
| B. |  如图用于分离I2和NH4Cl | |
| C. |  如图用于测定某NaOH溶液的浓度 | |
| D. | 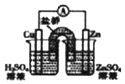 如装置能组成Cu-Zn原电池 |
| A. | 溶液的pH:①>③>② | |
| B. | 水电离出的(H+):③>②>① | |
| C. | ①和②等体积混合后的溶液:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | ①和③等体积混合后的溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
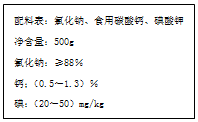 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题: