题目内容
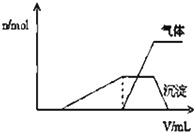 1L某混合溶液中可能含有的离子如下表:
1L某混合溶液中可能含有的离子如下表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ |
| 可能大量含有的阴离子 | Cl-Br-I?ClO?AlO2- |
①则该溶液中确定含有的离子有
②不能确定是否含有的阳离子有
③要确定其存在可补充做的实验是
④肯定不存在的阴离子有
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积 (标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为
考点:离子方程式的有关计算,离子反应发生的条件,常见离子的检验方法
专题:计算题
分析:(1)根据产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,一开始无沉淀,溶液中一定含有H+,能够与氢离子反应的离子不能存在;加NaOH有气体放出,则推断溶液中一定含有NH4+,沉淀最后完全消失,则溶液中只含有Al3+,不同金属阳离子灼烧呈现不同的焰色,据此解答;
(2)碘离子与溴离子的还原性强弱顺序为:I->Br-,加入氯气2.8L时溶液中I-amol,则说明通入2.8L Cl2只发生:Cl2+2I-═I2+2Cl-,2.8L变成5.6L,消耗2.8L Cl2的物质的量为
=0.125mol,发生:Cl2 +2Br-═Br2+2Cl-,Cl2+2I-═I2+2Cl-,根据反应方程式计算.
(2)碘离子与溴离子的还原性强弱顺序为:I->Br-,加入氯气2.8L时溶液中I-amol,则说明通入2.8L Cl2只发生:Cl2+2I-═I2+2Cl-,2.8L变成5.6L,消耗2.8L Cl2的物质的量为
| 2.8L |
| 22.4L/mol |
解答:
解:(1)从产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,开始时没有沉淀生成,说明溶液中氢离子,则一定没有ClO-、AlO2-;随后出现沉淀,且沉淀完全溶解了,说明沉淀是氢氧化铝,溶液中一定含有铝离子;氢氧化铝溶解前生成了气体,该气体一定是氨气,故溶液中一定含有铵离子;不能确定是否含有钾离子,可以通过灼烧溶液,透过蓝色的钴玻璃观察焰色确定钾离子的存在;
故答案为:H+、NH4+、Al3+;K+;焰色反应;CO3 2-、AlO2-;
(2)①由于碘离子与溴离子的还原性:I->Br-,加入氯气2.8L时溶液中I-amol,2.8L变成5.6L,消耗2.8LCl2的物质的量为
=0.125mol,发生:Cl2 +2Br-═Br2+2Cl-,Cl2+2I-═I2+2Cl-,Br-消耗0.1mol,需要氯气0.05mol,则说明开始通入2.8LCl2只发生:Cl2+2I-═I2+2Cl-,此时n(Cl2)=
=0.125mol,消耗n(I-)=2×0.125mol=0.25mol,生成n(Cl-)=2×0.125mol=0.25mol,此时n(Br-)=1.5mol,则说明原溶液中n(Br-)=1.5mol;
故答案为:Cl2+2I-═I2+2Cl-;
②通入氯气2.8L时,n(Br-)=1.5mol,所以原溶液中n(Br-)=1.5mol;
n(Cl-)=0.125mol×2=0.25mol,n(I-)=0.25mol,故原溶液中n(Cl-)=1.25mol-0.25mol=1mol;
通入氯气5.6L时,n(Br-)=1.5mol-1.4mol=0.1mol,n(I-)=0.25mol-0.1mol=0.15mol,故原溶液中n(I-)=0.25mol+0.15mol=0.4mol;
故原溶液中Cl-、Br-、I-的物质的量浓度之比为:1:1.5:0.4=10:15:4;
故答案为:10:15:4.
故答案为:H+、NH4+、Al3+;K+;焰色反应;CO3 2-、AlO2-;
(2)①由于碘离子与溴离子的还原性:I->Br-,加入氯气2.8L时溶液中I-amol,2.8L变成5.6L,消耗2.8LCl2的物质的量为
| 2.8L |
| 22.4L/mol |
| 2.8L |
| 22.4L/mol |
故答案为:Cl2+2I-═I2+2Cl-;
②通入氯气2.8L时,n(Br-)=1.5mol,所以原溶液中n(Br-)=1.5mol;
n(Cl-)=0.125mol×2=0.25mol,n(I-)=0.25mol,故原溶液中n(Cl-)=1.25mol-0.25mol=1mol;
通入氯气5.6L时,n(Br-)=1.5mol-1.4mol=0.1mol,n(I-)=0.25mol-0.1mol=0.15mol,故原溶液中n(I-)=0.25mol+0.15mol=0.4mol;
故原溶液中Cl-、Br-、I-的物质的量浓度之比为:1:1.5:0.4=10:15:4;
故答案为:10:15:4.
点评:本题考查离子的判断和有关计算,准确分析图标数据是解题关键,题目难度中等,注意根据离子的还原性以及表中数据判断反应的程度,结合方程式计算.

练习册系列答案
相关题目
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A、加入合金的质量不可能为6.4 g |
| B、参加反应的硝酸的物质的量为0.1 mol |
| C、沉淀完全时消耗NaOH溶液的体积为150 mL |
| D、溶解合金时收集到NO气体标准状况下的体积为2.24 L |
 恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )| A、物质A、B的转化率之比为a:b |
| B、起始时刻和达平衡后容器中的压强比为(a+b):(a+b-n/2) |
| C、平衡时C的体积分数为n/(a+b-n/2) |
| D、当v正(A)=2v逆(B)时,可判定反应达到平衡 |
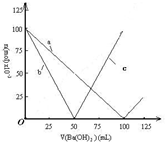 烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )
烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )| A、曲线a表示Ba2+的物质的量的变化 |
| B、曲线c表示OH-的物质的量的变化 |
| C、加入Ba(OH)2溶液50mL反应的离子方程式为Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| D、加入Ba(OH)2溶液大于50mL后,反应的离子方程式为 OH-+H+→H2O |
等浓度的NaOH溶液与氢硫酸溶液反应,下列说法不正确的是( )
| A、溶液中始终有:c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-) |
| B、t溶液呈中性时:c(Na+)═c(HS-)+c(S2-) |
| C、等体积混合后溶液中一定有:c(H2S)+c(H+)═c(S2-)+c(OH-) |
| D、恰好完全中和后的溶液中:c(Na+)>2c(S2-) |
己知反应A(s)+B(g)?C(g)+D(g)的化学平衡常数和温度的关系如表下列说法正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A、该反应的化学平衡常数表达式为:K=
| ||
| B、该反应为吸热反应 | ||
| C、单位时间内生成B和D的物质的量相等时,该反应处于平衡状态 | ||
| D、其它条件不变时,增大体系的压强,化学平衡常数减小 |