题目内容
石墨晶体中不存在的化学作用力是
- A.共价键
- B.氢键
- C.金属键
- D.范德华力
B
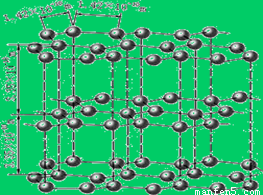
石墨是一种混合型晶体。石墨晶体中,同一层里面的碳原子之间以共价键相互结合,层与层之间是范德华力,石墨中的碳原子采取的是sp2杂化,每一个碳原上都有一个2p轨道与平面垂直,p电子可以在同一层中自由移动。只有氢键不存在,所以应该选择B项。
石墨是一种混合型晶体。石墨晶体中,同一层里面的碳原子之间以共价键相互结合,层与层之间是范德华力,石墨中的碳原子采取的是sp2杂化,每一个碳原上都有一个2p轨道与平面垂直,p电子可以在同一层中自由移动。只有氢键不存在,所以应该选择B项。

练习册系列答案
相关题目
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
| A.SO2和O3、PO43—和C1O4—互为等电子体 |
| B.甲烷分子失去一个H+,形成CH3—,其碳原子的杂化类型发生了改变 |
| C.Ti原子的核外电子排布式为[Ar]3d34s2 |
| D.CS2、H2O、C2H2都是直线型分子 |
(II)(14分)
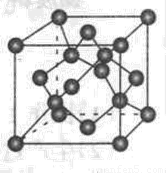
立方氮化硼
 是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐 ,比较下列原子的第一电离能:Be B,N O(填“>”“<”),其原因是 。
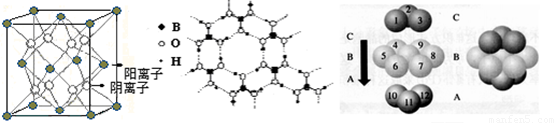
(2)下图为立方氮化硼的晶胞,则氮化硼的化学式为 ,该晶体中B原子填充N原子的 空隙。若该晶胞的边长为a cm,那么该晶体的密度为 g/cm3
(只要求列出算式)。
[来源:学科网ZXXK]

(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因
。
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为 ,请在上方的方框中画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每种原子不少于7个)。
 3N2(g)+4H2O(g)△H= —103 8.7kJ.mol—1,若该反应中有4mol
N—H键断裂,则形成的
3N2(g)+4H2O(g)△H= —103 8.7kJ.mol—1,若该反应中有4mol
N—H键断裂,则形成的 键有 mol。
键有 mol。 键有
mol。
键有
mol。