题目内容
某学生用0.1000mol?L-1标准氢氧化钠溶液滴定未知浓度的稀硫酸,其操作可分解为如下几步:
A.取20.00mL待测硫酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
(1)正确操作步骤的顺序为 (填序号);
(2)上述B步骤操作目的是 ;
(3)判断到达滴定终点的现象是 ;
(4)①达到滴定终点后发现碱式滴定管尖嘴部分有气泡,测定结果会 (填“偏大”“偏小”或“无影响”,下同);
②取待测硫酸溶液的酸式滴定管用蒸馏水洗涤后没有用该硫酸溶液润洗,测定结果会 ;
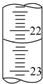
(5)请在右边的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分):
(6)完成3次平行实验,平均消耗标准氢氧化钠溶液体积为20.20mL,则待测液的物质的量浓度为 mol?L-1.
A.取20.00mL待测硫酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
(1)正确操作步骤的顺序为
(2)上述B步骤操作目的是
(3)判断到达滴定终点的现象是
(4)①达到滴定终点后发现碱式滴定管尖嘴部分有气泡,测定结果会
②取待测硫酸溶液的酸式滴定管用蒸馏水洗涤后没有用该硫酸溶液润洗,测定结果会
(5)请在右边的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分):

(6)完成3次平行实验,平均消耗标准氢氧化钠溶液体积为20.20mL,则待测液的物质的量浓度为
考点:中和滴定
专题:实验题
分析:(1)中和滴定有检漏、洗涤、润洗、装液、滴定等操作;
(2)滴定管需要润洗2-3次;
(3)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据c(酸)=
判断不当操作对相关物理量的影响;
(5)滴定管的刻度由上而下刻度增大,精度为0.01mL,据此结合图象读数;
(6)根据盐酸和氢氧化钠恰好反应,二者物质的量相等求出盐酸的浓度.
(2)滴定管需要润洗2-3次;
(3)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据c(酸)=
| c(碱)×V(碱) |
| V(酸) |
(5)滴定管的刻度由上而下刻度增大,精度为0.01mL,据此结合图象读数;
(6)根据盐酸和氢氧化钠恰好反应,二者物质的量相等求出盐酸的浓度.
解答:
解:(1)中和滴定按照检漏、洗涤、润洗、装液、滴定等顺序操作,故答案为:BDCEAF;
(2)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2-3次,故答案为:防止滴定管内壁附着的水将标准溶液稀释而带来误差;
(3)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
(4)①达到滴定终点后发现碱式滴定管尖嘴部分有气泡,会导致碱的体积偏小,根据c(酸)=
×
,故计算c(酸)偏小,②酸式滴定管在装液前未用标准硫酸溶液润洗2~3次,待测液浓度偏小,故答案为:偏小;偏小;
(5)正在排气泡的碱式滴定管为: ,故答案为:
,故答案为: ;
;
(6)由于此酸为二元酸,故酸的浓度为氢离子浓度的一半,即c(酸)=
×
=
=0.05050mol/L,故答案为:0.05050.
(2)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2-3次,故答案为:防止滴定管内壁附着的水将标准溶液稀释而带来误差;
(3)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
(4)①达到滴定终点后发现碱式滴定管尖嘴部分有气泡,会导致碱的体积偏小,根据c(酸)=
| 1 |
| 2 |
| c(碱)×V(碱) |
| V(酸) |
(5)正在排气泡的碱式滴定管为:
 ,故答案为:
,故答案为: ;
;(6)由于此酸为二元酸,故酸的浓度为氢离子浓度的一半,即c(酸)=
| 1 |
| 2 |
| c(碱)×V(碱) |
| V(酸) |
| 0.1000mol/L×20.20ml |
| 20.00mL |
点评:本题主要考查的是酸碱中和滴定,难度中等,注意理解滴定的原理与操作.

练习册系列答案
相关题目
A、B、C、D、E、F为六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、,C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.下列说法正确的是( )
| A、原子半径:D>E>F>C>B>A |
| B、A、C、D三种元素形成的化合物与C、D、F三种元素形成的化合物晶体类型相同,化学键类型也相同,水溶液的酸碱性相同,造成溶液酸碱性的原理也相同 |
| C、A、C、E三种元素形成的化合物,在加热条件下一定能与铜反应 |
| D、B与F两种元素形成的一种化合物分子,各原子均达8电子结构,其中B显负价,F显正价,则该化合物与水反应生成ACF与BA3两种产物 |
下列晶体熔点高低顺序正确的是( )
| A、NaCl>KCl>SiO2>I2 |
| B、HI>HBr>HCl>HF |
| C、金刚石>SiC>晶体硅 |
| D、Cs>Rb>K>Na |
下列各项反应中,升高温度,平衡常数减小的是( )
| A、2SO3?2SO2+O2 |
| B、H2PO4-+H2O?HPO42-+H3O+ |
| C、Fe3++3H2O?Fe(OH)3+3H+ |
| D、CH3COOH+OH-?CH3COO+H2O |
把一定物质的量的金属钠投入到mg足量水中充分反应后得到ag溶液,把与钠物质的量相等的金属镁投入到mg足量盐酸中充分反应后得到bg溶液,则a、b的关系是( )
| A、a>b | B、a<b |
| C、a=b | D、无法确定 |
 实验室中有一未知浓度的稀盐酸,某学生用0.10mol?L-1 NaOH标准溶液进行测定盐酸的浓度的实验.取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生用0.10mol?L-1 NaOH标准溶液进行测定盐酸的浓度的实验.取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.请完成下列填空: