题目内容
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途.干法、湿法制备高铁酸盐的原理如下表所示.
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
 △
△(1)干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为______.
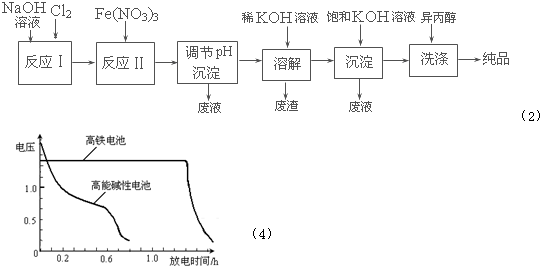
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:溶解
①反应I的化学方程式为______.
②反应II的离子方程式为______.
③加入饱和KOH溶液的目的是______.
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为______,它能净水的原因是
______.
(4)高铁电池是正在研制中的可充电干电池,右图为高铁电池和常用的高能碱性电池的放电曲线,由图可得出高铁电池的优点有:工作电压稳定,______.
解:(1)Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,氮元素的化合价降低,铁元素的化合价升高,则KNO3为氧化剂,Fe2O3为还原剂,氧化剂与还原剂的物质的量之比为3:1,故答案为:3:1;
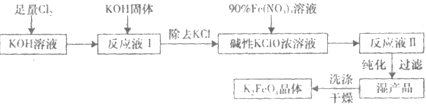
(2)根据流程确定混合物Ⅰ的组成为氯化钠、次氯酸钠以及氢氧化钠的混合物,经过反应②之后所得混合物II的组成有NaNO3、NaCl、NaOH、K2FeO4,从中分离出K2FeO4后,得到的副产品是NaNO3、NaCl、NaOH以及氢氧化钠.
①氯气与氢氧化钠反应生成的是氯化钠、次氯酸钠和水,反应方程式为,2NaOH+Cl2=NaCl+NaClO+H2O;
故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;
②ClO-在碱性条件下可将Fe3+氧化为FeO42-,反应方程式为,3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
③加入饱和KOH溶液增大反应物K+的浓度,使平衡右移,促进K2FeO4晶体析出.
故答案为:增大K+浓度,促进K2FeO4晶体析出.
(3)高铁酸钾(K2FeO4)在水中能消毒杀菌是因为有强氧化性,净水的原因是高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性,使水澄清起净水作用,
故答案为:高铁酸钾(K2FeO4)有强氧化性;高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性(有絮凝作用),使水澄清起净水作用.
(4)由图知高铁电池比高能碱性电池放电时间长.故答案为:放电时间长.
分析:(1)根据含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,并利用化学反应方程式中的化学计量数来分析氧化剂与还原剂的物质的量之比;
(2)根据物质的性质写出反应的化学方程式,加入饱和KOH溶液增大反应物的浓度,使平衡右移;
(3)高铁酸钾在水中能消毒杀菌是因为有强氧化性,净水的原因是高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性;
(4)由图知高铁电池比高能碱性电池放电时间长.
点评:本题考查氧化还原反应,离子方程式的书写,化学平衡的移动,明确利用元素的化合价变化来分析氧化剂、还原剂时解答的关键.
(2)根据流程确定混合物Ⅰ的组成为氯化钠、次氯酸钠以及氢氧化钠的混合物,经过反应②之后所得混合物II的组成有NaNO3、NaCl、NaOH、K2FeO4,从中分离出K2FeO4后,得到的副产品是NaNO3、NaCl、NaOH以及氢氧化钠.
①氯气与氢氧化钠反应生成的是氯化钠、次氯酸钠和水,反应方程式为,2NaOH+Cl2=NaCl+NaClO+H2O;
故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;
②ClO-在碱性条件下可将Fe3+氧化为FeO42-,反应方程式为,3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
③加入饱和KOH溶液增大反应物K+的浓度,使平衡右移,促进K2FeO4晶体析出.
故答案为:增大K+浓度,促进K2FeO4晶体析出.
(3)高铁酸钾(K2FeO4)在水中能消毒杀菌是因为有强氧化性,净水的原因是高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性,使水澄清起净水作用,
故答案为:高铁酸钾(K2FeO4)有强氧化性;高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性(有絮凝作用),使水澄清起净水作用.
(4)由图知高铁电池比高能碱性电池放电时间长.故答案为:放电时间长.
分析:(1)根据含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,并利用化学反应方程式中的化学计量数来分析氧化剂与还原剂的物质的量之比;
(2)根据物质的性质写出反应的化学方程式,加入饱和KOH溶液增大反应物的浓度,使平衡右移;
(3)高铁酸钾在水中能消毒杀菌是因为有强氧化性,净水的原因是高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性;
(4)由图知高铁电池比高能碱性电池放电时间长.
点评:本题考查氧化还原反应,离子方程式的书写,化学平衡的移动,明确利用元素的化合价变化来分析氧化剂、还原剂时解答的关键.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途.干法、湿法制备高铁酸盐的原理如下表所示.
 △
△
(1)干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为______.
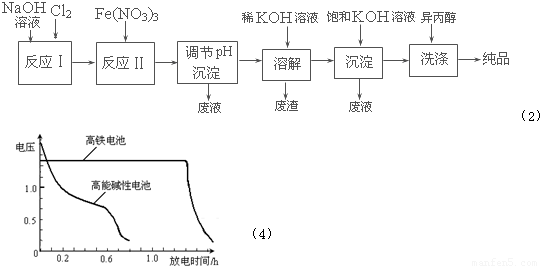
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:溶解
①反应I的化学方程式为______.
②反应II的离子方程式为______.
③加入饱和KOH溶液的目的是______.
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为______,它能净水的原因是
______.
(4)高铁电池是正在研制中的可充电干电池,右图为高铁电池和常用的高能碱性电池的放电曲线,由图可得出高铁电池的优点有:工作电压稳定,______.
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
 △
△(1)干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为______.
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:溶解
①反应I的化学方程式为______.
②反应II的离子方程式为______.
③加入饱和KOH溶液的目的是______.
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为______,它能净水的原因是
______.
(4)高铁电池是正在研制中的可充电干电池,右图为高铁电池和常用的高能碱性电池的放电曲线,由图可得出高铁电池的优点有:工作电压稳定,______.
 △
△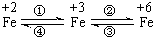 亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见图).利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究.
亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见图).利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究.