题目内容
9.将铜片和铝片用导线连接后插入盛有浓硝酸的烧杯中组成原电池,此原电池的负极及其电极反应分别是( )| A. | Al,Al-3e-=Al3+ | B. | Cu,Cu-2e-=Cu2+ | ||
| C. | Al,2H++2e-=H2↑ | D. | Cu,2H++NO3-+e-=NO2↑+H2O |
分析 失电子的一极为负极,Al遇到浓硝酸会钝化,Cu与浓硝酸反应失电子,则Cu失电子,Cu为负极,Al为正极,据此分析.
解答 解:由Al、Cu、浓硝酸组成的原电池,Al遇到浓硝酸会钝化,Cu与浓硝酸反应失电子,Cu作负极,负极电极反应为:Cu-2e-=Cu2+,故选B.
点评 本题考查原电池知识,侧重于原电池的组成、电极以及工作原理的考查,题目难度不大,注意相关基础知识的理解.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
5.物质的量符号为( )
| A. | M | B. | m | C. | n | D. | V |
6.下列说法正确的是( )
| A. | 1mol蔗糖可以水解生成2mol葡萄糖 | |
| B. | 乙醇发生消去反应可制得乙烯 | |
| C. | (CH3)2CHCH(CH3)2的名称是2,3-甲基丁烷 | |
| D. | 棉,麻,丝,毛燃烧后都只生成CO2和H2O |
17.在水中加入下列物质,可使水的电离平衡正向移动的是( )
| A. | NaOH | B. | NH4Cl | C. | NaCl | D. | H2SO4 |
14.向一定质量的稀盐酸中加入镁粉至过量,图中横坐标表示镁粉的质量,则纵坐标表示( ) 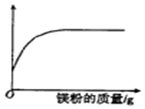

| A. | 溶液的质量 | B. | 稀盐酸的质量 | C. | 氯化镁的质量 | D. | 生成气体的质量 |
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 向氯水中加食盐不利于氯气的溶解 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | 高压有利于合成氨的反应 |
18.化学“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动.下列利用家庭日常生活用品进行的实验都能达到如期目的一组是( )
①用碘酒来证明马铃薯中含有淀粉
②用食醋除去热水瓶中的水垢
③用肥皂水来检验自来水是否含有过多的Ca2+、Mg2+
④用聚光手电筒检验淀粉溶液具有丁达尔现象
⑤用肥皂水涂抹被蜂、蚁蜇咬后而引起的皮肤肿痛
⑥用食盐来吸收摔破的水银温度计中的水银.
①用碘酒来证明马铃薯中含有淀粉
②用食醋除去热水瓶中的水垢
③用肥皂水来检验自来水是否含有过多的Ca2+、Mg2+
④用聚光手电筒检验淀粉溶液具有丁达尔现象
⑤用肥皂水涂抹被蜂、蚁蜇咬后而引起的皮肤肿痛
⑥用食盐来吸收摔破的水银温度计中的水银.
| A. | ①②⑤⑥ | B. | ①②③④⑤ | C. | ②③④⑥ | D. | ①②③④⑥ |
19.“塑胶”跑道是由聚氨酯橡胶等材料建成.聚氨酯橡胶属于( )
| A. | 金属材料 | B. | 无机非金属材料 | ||
| C. | 有机高分子材料 | D. | 传统无机非金属材料 |