题目内容
氨气是一种重要的基础化工原料,用途广泛.
在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境.该反应的化学方程式为2NH3+3H2O2═
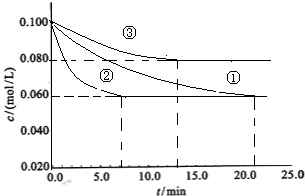
工业中常用以下反应合成氨:N2+3H2?2NH3△H<0.某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示.
(1)该反应平衡常数的数学表达式
;实验②平衡时H2的转化率为
(2)据图所示,②、③两装置中各有一个条件与①不同.请指出,并说明判断的理由.
②条件:
③条件:
在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境.该反应的化学方程式为2NH3+3H2O2═
N2
N2
+6H2O工业中常用以下反应合成氨:N2+3H2?2NH3△H<0.某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示.

(1)该反应平衡常数的数学表达式
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
40%
40%
(2)据图所示,②、③两装置中各有一个条件与①不同.请指出,并说明判断的理由.
②条件:
加了催化剂
加了催化剂
理由:因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动所以①②两装置达到平衡时N2的浓度相同.
因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动所以①②两装置达到平衡时N2的浓度相同.
③条件:
温度升高
温度升高
理由:该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
.分析:根据质量守恒定律推断未知物;
(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
实验②平衡时H2的转化率为α(H2)=
×100%
(2)②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动;
③到达平衡的时间比①短,到达平衡时N2的浓度高于①,与①相比,平衡向逆反应方向移动.
(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
实验②平衡时H2的转化率为α(H2)=
| △c(H2) |
| c起始(H2) |
(2)②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动;
③到达平衡的时间比①短,到达平衡时N2的浓度高于①,与①相比,平衡向逆反应方向移动.
解答:解:根据质量守恒定律,反应前后的元素及原子守恒,则推知未知物为N2,故答案为:N2;
(1)该反应平衡常数的数学表达式k=
;
浓度变化量之比等于化学计量数之比,所以△c(H2)=3△c(N2)=3×(0.1-0.06 )mol/L=0.12mol/L,
实验②平衡时H2的转化率为α(H2)=
×100%=
×100%=40%.
故答案为:
;40%;
(2)②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂,
故答案为:加了催化剂;因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动所以①②两装置达到平衡时N2的浓度相同;
③到达平衡的时间比①短,到达平衡时N2的浓度高于①,与①相比,平衡向逆反应方向移动,故③与①相比温度升高,
故答案为:温度升高;该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①.
(1)该反应平衡常数的数学表达式k=
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
浓度变化量之比等于化学计量数之比,所以△c(H2)=3△c(N2)=3×(0.1-0.06 )mol/L=0.12mol/L,
实验②平衡时H2的转化率为α(H2)=
| △c(H2) |
| c起始(H2) |
| 0.12mol/L |
| 0.3mol/L |
故答案为:
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
(2)②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂,
故答案为:加了催化剂;因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动所以①②两装置达到平衡时N2的浓度相同;
③到达平衡的时间比①短,到达平衡时N2的浓度高于①,与①相比,平衡向逆反应方向移动,故③与①相比温度升高,
故答案为:温度升高;该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①.
点评:本题考查了化学平衡常数、影响因素及有关计算等,注意计算平衡常数时表达式中的浓度为平衡浓度,不是任意时刻的浓度.

练习册系列答案
相关题目
 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) = 0.100mol/L, c(H2)
= 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) = 0.100mol/L, c(H2)
= 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)=0.100mol/L,
C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)=0.100mol/L,
C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。