题目内容
R2O8n-在一定条件下可以把Mn2+氧化成MnO4- ,若反应中R2O8n- 变为RO42 -,又知反应中氧化剂与还原剂的物质的量之比为5∶2,则n值为
A.1 B.2 C.3 D.4
B
【解析】
试题分析:锰的化合价从+2价升高到+7价,失去5个电子,根据电子的得失守恒可知,1 mol氧化剂所得到的电子是2 mol×5÷5 mol=2 mol。所以R的在反应中得到1个电子,反应前R的化合价是6+1=+7价,则n=2,选B。
考点:考查氧化还原反应的有关计算。

 名校课堂系列答案
名校课堂系列答案(17分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为: 。装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为 色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式: 。
(5)如果将过量二氧化锰与20 mL 12 mol·L-1的浓盐酸混合加热,充分反应后生成的氯气 0.06 mol。(填“大于”“小于”“等于”),若有17.4 g的MnO2被还原,则被氧化的HCl的质量为 。
下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Fe | Fe | NaOH溶液 | BaCl2溶液 |
(7分)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。请完成下列填空:
取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验 编号 | NaOH溶液的浓度 (mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.50 | 20.00 |
2 | 0.10 | 25.80 | 20.00 |
3 | 0.10 | 22.62 | 20.00 |
(1)滴定达到终点的标志是 。
(2)根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)。
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
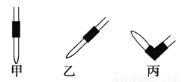
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______(填选项字母)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
 [CuCl4]2—(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色
[CuCl4]2—(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色