题目内容
18.用电子式表示CaF2的形成过程 .
.
分析 氟化钙为离子化合物,钙离子与两个氟离子通过离子键结合,阴阳离子需要标出所带电荷,据此解答.
解答 解:氟化钙为离子化合物,阴阳离子需要标出所带电荷,用电子式表示其形成过程为: ,
,
故答案为: .
.
点评 本题考查了用电子式表示化合物的形成过程,明确物质所含化学键类型、电子式的书写方法为解答关键,注意掌握离子化合物与共价化合物的电子式的区别,题目难度中等,

练习册系列答案
相关题目
8.在2L密闭容器内,加入0.100molCO气体和0.080molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)?Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
(1)用CO表示前2min内的化学反应速率=0.005mol/(L.min)
(2)计算此反应在800°C时的化学平衡常数k=0.429
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正)<V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得.
已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol
则C(s)+H2O(g)?CO(g)+H2(g)△H=+175.3kj/mol.
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(2)计算此反应在800°C时的化学平衡常数k=0.429
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正)<V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得.
已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol
则C(s)+H2O(g)?CO(g)+H2(g)△H=+175.3kj/mol.
9.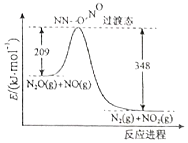 请完成下列问题
请完成下列问题
(1)已知红磷比白磷稳定,则反应
P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(红磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的关系是△H1<△H2(填“>”、“<”)
(2)由N2O和NO反应生成1mol N2和NO2的能量变化如图所示,请写出该反应的热化学方程式N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•moL-1
(3)在298K、101kPa时,已知:
①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3,
则△H3与△H1和△H2之间的关系正确的是A.
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1-2△H2D.△H3=△H1-△H2
(4)已知H2(g)+Br2(g)═2HBr(g)△H=-72kJ?mol-1,相关键能数据如表:
则表中a=354.
 请完成下列问题
请完成下列问题(1)已知红磷比白磷稳定,则反应
P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(红磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的关系是△H1<△H2(填“>”、“<”)
(2)由N2O和NO反应生成1mol N2和NO2的能量变化如图所示,请写出该反应的热化学方程式N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•moL-1
(3)在298K、101kPa时,已知:
①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3,
则△H3与△H1和△H2之间的关系正确的是A.
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1-2△H2D.△H3=△H1-△H2
(4)已知H2(g)+Br2(g)═2HBr(g)△H=-72kJ?mol-1,相关键能数据如表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
13.容量瓶是一种定量仪器,其瓶身上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥密度
这六项中的( )
这六项中的( )
| A. | ②④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
3.表格中各项分类都正确的一组是( )
| 类别 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 苏打 | 纯净空气 | CaCO3 | 干冰 |
| B | 碘酒 | 漂白粉 | NH3•H20 | Fe |
| C | 明矾 | 铝合金 | 石墨 | 醋酸 |
| D | 盐酸 | CuSO4•5H2O | Na2SO4 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
10.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,32 g O3含有的氧原子数目为2NA | |
| B. | 5.6 g的Fe在足量Cl2中完全燃烧转移电子数为0.2NA | |
| C. | 0.1 mol•L-1 Na2SO4溶液含有的钠离子数目为0.2NA | |
| D. | 标准状况下,22.4 L苯含有的碳原子数目为6NA |
10. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{c{\;}^{2}(NO{\;}_{2})}{c{\;}^{2}(NO)×c(O{\;}_{2})}$
已知:K300°C>K350°C,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v (NO2)=2v (O2) b.容器内压强保持不变
c.v逆(NO)=2v正 (O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
HNO2是一种弱酸,部分弱酸的电离平衡常数如下表:
(5)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:Ki值越大,酸性越强.
(6)下列离子方程式正确的是BD
A.2ClO-+H2O+CO2→2HClO+CO32-
B.2HNO2+CO32-→2NO2-+H2O+CO2↑
C.H2SO3+CO32-→CO2+H2O+SO32-
D.Cl2+H2O+2CO32-→2HCO3-+Cl-+ClO-
(7)常温下,pH=3的HNO2溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为c(NO2-)>c(Na+)>c(H+)>c(OH-).
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
已知:K300°C>K350°C,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v (NO2)=2v (O2) b.容器内压强保持不变
c.v逆(NO)=2v正 (O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
HNO2是一种弱酸,部分弱酸的电离平衡常数如下表:
| 弱酸 | HNO2 | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | Ki=5.1×10-4 | Ki=2.98×10-8 | $\begin{array}{l}{K_{i1}}=4.3×{10^{-7}}\\{K_{i2}}=5.6×{10^{-11}}\end{array}$ | $\begin{array}{l}{K_{i1}}=1.54×{10^{-2}}\\{K_{i2}}=1.02×{10^{-7}}\end{array}$ |
(6)下列离子方程式正确的是BD
A.2ClO-+H2O+CO2→2HClO+CO32-
B.2HNO2+CO32-→2NO2-+H2O+CO2↑
C.H2SO3+CO32-→CO2+H2O+SO32-
D.Cl2+H2O+2CO32-→2HCO3-+Cl-+ClO-
(7)常温下,pH=3的HNO2溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为c(NO2-)>c(Na+)>c(H+)>c(OH-).
 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测: Ⅰ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
Ⅰ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步: