题目内容
已知铜和硝酸反应生成硝酸铜、氮的氧化物和水.现有5.12g铜和一定量的浓硝酸反应,当铜溶解完全时,共收集到标准状况下的气体3.36L;若把这些气体和“一定量的氧气”充分混合后通入水中,气体又完全反应生成硝酸,试计算“一定量的氧气”在标准状况下的体积.
考点:硝酸的化学性质
专题:计算题
分析:Cu和硝酸反应生成氮氧化物时,铜失电子、硝酸根离子得电子且得失电子相等,将氮氧化物和氧气溶于水时,氮氧化物失电子、氧气得电子而生成硝酸,根据转移电子相等知,铜失去电子的物质的量等于氧气得到电子的物质的量,据此分析解答.
解答:
解:铜与硝酸反应时,铜失电子.硝酸中的N原子得电子后转化为氮的氧化物,氮的氧化物与氧气共同作用于水时,N原子又将电子转移给参加反应的氧原子,故铜失去的电子数与氧原子得到的电子数相等,即:假设需要氧气VL,则
×2=
×4,V=0.896L,
答:“一定量的氧气”在标准状况下的体积是0.896L.
| 5.12g |
| 64g/mol |
| V |
| 22.4L/mol |
答:“一定量的氧气”在标准状况下的体积是0.896L.
点评:本题以硝酸为载体考查了物质的量的计算,明确反应过程中铜和氧气之间的关系是解本题关键,再结合转移电子相等计算即可,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
下列离子组一定能大量共存的是( )
| A、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | ||
B、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HC
| ||
| C、pH=13的溶液中:K+、Na+、NO3-、ClO- | ||
| D、氯化铝溶液中Na+、AlO2-、NO3-、HCO3- |
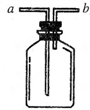 (1)现有人图所示装置,为实现下列实验目的,其中应以a端作为入口的是
(1)现有人图所示装置,为实现下列实验目的,其中应以a端作为入口的是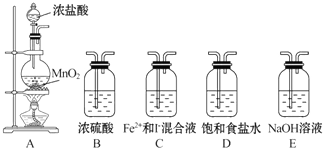
 A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素.A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍.请回答下列问题:
A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素.A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍.请回答下列问题: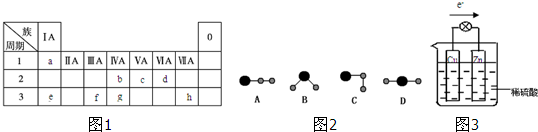
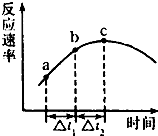 NO、NO2、SO2、CO等均为大气污染物,研究这些气体的吸收和处理意义重大.请回答下列问题:
NO、NO2、SO2、CO等均为大气污染物,研究这些气体的吸收和处理意义重大.请回答下列问题: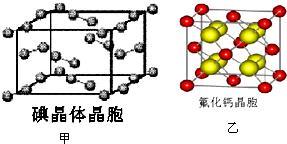 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6