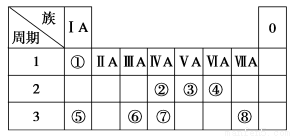
题目内容
将KClO3、I2各0.02 mol加入12 克36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发)。将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),过滤,将滤液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气。则A的化学式可能是( )
A.I2Cl6 B.ICl5 C.HClO D. KIO3
A
【解析】
试题分析:根据题中信息,KClO3、I2等物质的量发生了氧化还原反应,根据电子守恒,KClO3作氧化剂,还原产物中有氯离子生成,碘作还原剂,碘元素化合价升高。假设有1molKClO3反应,则转移6mol电子,必将有1mol碘参加反应,产物中碘的化合价是+3价,只有I2Cl6 满足反应条件,故选项是A。
考点:考查守恒法中物质的化学式的确定的应用的知识。

练习册系列答案
相关题目
下列反应中乙醇分子只断裂C-O键的是( )
| A、乙醇与金属钠反应产生氢气 | B、乙醇在浓硫酸存在下加热产生乙烯 | C、乙醇与氢卤酸发生取代反应生成卤代烃 | D、乙醇与酸性重铬酸钾溶液作用 |
下列实验操作与预期的实验目的或结论均正确的是 ( )
选项 | 实验操作 | 预期的实验目的或结论 |
A | 对某白色固体进行焰色反应实验,火焰呈黄色 | 该物质为钠盐 |
B | SO2通入某红色溶液中,溶液褪色 | 该溶液为品红溶液 |
C | pH均为12的NaOH溶液、氨水分别用蒸馏水稀释 m倍、n倍后的pH相同 | m<n |
D | 蔗糖溶液中加入少量稀硫酸加热,然后加银氨溶液再加热 | 验证蔗糖是否发生水解 |