题目内容
取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的离子方程式为 ,反应后得到的FeCl3溶液呈棕黄色.用此溶液进行以下实验:
(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子程式为 ,此反应属于基本反应类型中的 反应.
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈 色,停止加热,制得的分散系为 .
(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子程式为
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈
考点:离子方程式的书写,分散系、胶体与溶液的概念及关系,化学基本反应类型
专题:
分析:氧化铁与盐酸反应生成氯化铁和水,
(1)铁离子与NaOH反应生成氢氧化铁沉淀;
(2)铁离子水解生成胶体.
(1)铁离子与NaOH反应生成氢氧化铁沉淀;
(2)铁离子水解生成胶体.
解答:
解:氧化铁与盐酸反应生成氯化铁和水,离子反应为6H++Fe2O3=2Fe3++3H2O,故答案为:6H++Fe2O3=2Fe3++3H2O;
(1)滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子程式为Fe3++3OH-=Fe(OH)3↓,属于复分解反应,故答案为:Fe3++3OH-=Fe(OH)3↓;复分解;
(2)加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,液体为胶体分散系,故答案为:红褐;胶体.
(1)滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子程式为Fe3++3OH-=Fe(OH)3↓,属于复分解反应,故答案为:Fe3++3OH-=Fe(OH)3↓;复分解;
(2)加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,液体为胶体分散系,故答案为:红褐;胶体.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解与复分解的离子反应考查,题目难度不大.

练习册系列答案
相关题目
51.2克铜完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共0.8mol,这些气体恰好能被500ml 2mol?L-1 的氢氧化钠溶液完全吸收,生成的盐为硝酸钠和亚硝酸钠,则氮的氧化物中的NO的物质的量为( )
| A、0.2 mol |
| B、0.3 mol |
| C、0.4 mol |
| D、0.5 mol |
设NA表为阿伏加德罗常数的值,下列说法中正确的是( )
| A、4.6g钠与足量水反应,生成Na+离子的数目为0.2NA |
| B、标准状况下,4.48L水中含有H2O分子的数目为0.2NA |
| C、0.3mol 氯气中含有Cl原子的数目为0.3NA |
| D、0.2 mol/L CaCl2溶液中含有Clˉ离子的数目为0.4NA |
下列有关物质的性质、制取或应用等的说法中正确的是( )
| A、用8%的盐酸蒸发浓缩获得30%的盐酸 |
| B、光纤和餐桌上的瓷盘都是硅酸盐制品 |
| C、可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
| D、二氧化硫具有漂白性,与氯水混合使用漂白效果更好 |
对下列化学用语的理解和描述均正确的是( )
A、原子结构示意图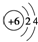 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
B、比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、结构示意图为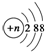 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D、电子式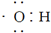 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
 某无色气体可能由O2、CO、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减少(该装置前后都不与大气直接相连),通过干燥管(内盛放Na2O2)后气体呈红棕色,则下列推断正确的是( )
某无色气体可能由O2、CO、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减少(该装置前后都不与大气直接相连),通过干燥管(内盛放Na2O2)后气体呈红棕色,则下列推断正确的是( )| A、原气体中一定有NO和O2 |
| B、原气体中一定有NH3、NO、CO2、CO |
| C、原气体中一定没有CO |
| D、原气体中一定没有HCl、Br2、O2 |