题目内容
8.下列关于丙烯(CH3CH=CH2)的说法正确的是( )| A. | 丙烯分子有7个σ键和1个π键 | |
| B. | 丙烯分子中有3个碳原子在同一直线上 | |
| C. | 丙烯分子中3个碳原子都是sp3杂化面上 | |
| D. | 丙烯分子存在非极性键 |
分析 A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键;
B.由C=C双键为平面结构、甲基为四面体结构分析;
C.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化;
D.同种非元素之间形成非极性键.
解答 解:A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故A错误;
B.由C=C双键为平面结构、甲基为四面体结构可知,丙烯分子中2个碳原子在同一直线,故B错误;
C.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化,则丙烯分子中1个碳原子是sp3杂化,2个碳原子是sp2杂化,故C错误;
D.同种非元素之间形成非极性键,则丙烯中存在C-C非极性共价键,故D正确.
故选D.
点评 本题考查共价键及分类,为高频考点,侧重于学生的分析能力的考查,注意判断共价键的规律和常见有机物的空间结构来解答,杂化类型为解答的易错点,题目难度不大.

练习册系列答案
相关题目
18.80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20~40s 内用N2O4表示的平均反应速率为0.002 mol•L-1•s-1.
(2)计算在80℃时该反应的平衡常数K=1.8.
(3)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4 起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度.
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K=1.8.
(3)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4 起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度.
16.下列离子能大量共存的是( )
| A. | K+、OH-、Na+、CO32- | B. | Cl-、Na+、Ag+、NO3- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | NH4+、Cl-、Na+、OH- |
3.下列冶炼金属的原理中,属于热还原法的是( )
| A. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2↑ | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | 2NaC12$\frac{\underline{\;电解\;}}{\;}$2Na+C12↑ |
13.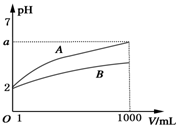 pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
 pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )| A. | 稀释后A溶液的酸性比B溶液弱 | |
| B. | a=5时,A是强酸,B是弱酸 | |
| C. | 若A、B都是弱酸,则5>a>2 | |
| D. | A、B两种酸溶液物质的量浓度一定相等 |
17.以下物质必须贮存在具有橡胶塞的玻璃试剂瓶中的是( )
①KOH溶液②Na2SiO3溶液③盐酸④氢氟酸⑤澄清石灰水⑥液溴⑦苏打溶液.
①KOH溶液②Na2SiO3溶液③盐酸④氢氟酸⑤澄清石灰水⑥液溴⑦苏打溶液.
| A. | ①⑤⑦ | B. | ①②⑤⑦ | C. | ①②④⑤⑦ | D. | ②③④⑥ |
18.以下物质间的每步转化通过一步反应能实现的是( )
| A. | Si→SiO2→H2SiO4→Na2SiO3 | B. | Fe→FeCl2→FeCl3→Fe(OH)3 | ||
| C. | Na→Na2CO2→Na2O2→NaOH | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题: