��Ŀ����
�������£�����������Һ��
��0.1 mol/L��NH4Cl����0.1 mol/L��CH3COONH4����0.1 mol/L��NH4HSO4����0.1 mol/L��NH3��H2O��0.1 mol/L��NH4Cl���Һ����0.1 mol/L��NH3��H2O
�����Ҫ����д���пհף�
(1)��Һ�ٳ�________��(��ᡱ��������С�)����ԭ����________(�����ӷ���ʽ��ʾ)
(2)������������Һ�У�pH��С����________��c(NH4+)��С����________(�����)
(3)�Ƚ���Һ�ڡ�����c(NH4+)�Ĵ�С��ϵ�Ǣ�________��(�����������������)
(4)����Һ���У�________���ӵ�Ũ��Ϊ0.1 mol/L��NH3��H2O��________���ӵ����ʵ���Ũ��֮��Ϊ0.2 mol/L
(5)�����£������Һ�ڵ�pH��7����˵��CH3COO����ˮ��̶�________(�����������������)NH4+��ˮ��̶ȣ�CH3COO����NH4+Ũ�ȵĴ�С��ϵ�ǣ�
c(CH3COO��)________c(NH4+)(�����������������)

 �����ܿ����ϵ�д�
�����ܿ����ϵ�д���ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ���ˮ��ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
���ں����ܱ������У�������Ӧ3A(g)��B(g) 2C(g)����H��Q kJ/mol���ش��������⣺
2C(g)����H��Q kJ/mol���ش��������⣺
��1��д���÷�Ӧƽ�ⳣ���ı���ʽ__________��
��2�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________(�����)��
�� v(A)��3v(B) �ڻ��������ܶȱ��ֲ��䡡
����3 mol A���ĵ�ͬʱ��1 mol B���ɡ� ��C��Ũ�ȱ��ֲ���
��3������ʵ���õ����ݿ�֪���¶�Խ�߸÷�Ӧ�Ļ�ѧƽ�ⳣ��Խ����Q______0(����ڡ���С�ڡ�)��
��1�������£�ȡpH��2������ʹ�����Һ��100 mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ���________(�� ��a����b��)���������м���Zn����Ϊm1��������Һ�м����Zn����Ϊm2����m1________m2(ѡ�����������������)��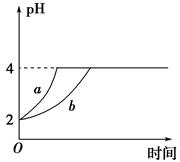
��2����������pH��2������ʹ�����Һ�� 100 mL���ֱ��ˮϡ�ͺ�ʹpH��4���������м���ˮ�����ΪV1��������Һ�м����ˮ�����ΪV2���� V1______V2(���������������)��
�����£�Ũ�Ⱦ�Ϊ0.1 mol/L ������������Һ��pH���±���
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
��2�����ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01 mol/L �������������ʵ���Һ�У�������ǿ����_______ �����ţ� �� ������Һ�ֱ�ϡ��100���� pH�仯��С���� �����ţ� ��
A��HCN B��HClO C��C6H5OH D��CH3COOH E��H2CO3
��3�����ϱ����ݣ������ж����з�Ӧ���ܳ������� �����ţ���
A��CH3COOH�� Na2CO3��NaHCO3��CH3COONa
B��CH3COOH��NaCN��CH3COONa��HCN
C��CO2��H2O��2C6H5 ONa��Na2CO3��2C6H5OH
������֪��ZnCl2��xH2O������ˮ������Ũ��ˮ��Һ�ʽ�ǿ���ԣ�SOCl2 (�Ȼ�����)����ˮ�������·�Ӧ��SOCl2��H2O=SO2��2HCl��ʵ��������ȡ��ˮ�Ȼ�п����ZnCl2��xH2O��SOCl2��ϼ��ȵķ������Իش�
SOCl2��������___________________________________��
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ���ˮ��ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
���ں����ܱ������У�������Ӧ3A(g)��B(g) 2C(g)����H��Q kJ/mol���ش��������⣺
2C(g)����H��Q kJ/mol���ش��������⣺
��1��д���÷�Ӧƽ�ⳣ���ı���ʽ__________��
��2�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________(�����)��
�� v(A)��3v(B) �ڻ��������ܶȱ��ֲ��䡡
����3 mol A���ĵ�ͬʱ��1 mol B���ɡ� ��C��Ũ�ȱ��ֲ���
��3������ʵ���õ����ݿ�֪���¶�Խ�߸÷�Ӧ�Ļ�ѧƽ�ⳣ��Խ����Q______0(����ڡ���С�ڡ�)��
��1�������£�ȡpH��2������ʹ�����Һ��100 mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ���________(�� ��a����b��)���������м���Zn����Ϊm1��������Һ�м����Zn����Ϊm2����m1________m2(ѡ�����������������)��

��2����������pH��2������ʹ�����Һ�� 100 mL���ֱ��ˮϡ�ͺ�ʹpH��4���������м���ˮ�����ΪV1��������Һ�м����ˮ�����ΪV2���� V1______V2(���������������)��
�����£�Ũ�Ⱦ�Ϊ0.1 mol/L ������������Һ��pH���±���
|
���� |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
��1����������Һ�е������ӣ����H+������ǿ����
��2�����ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01 mol/L �������������ʵ���Һ�У�������ǿ����_______ �����ţ� �� ������Һ�ֱ�ϡ��100���� pH�仯��С���� �����ţ� ��
A��HCN B��HClO C��C6H5OH D��CH3COOH E��H2CO3
��3�����ϱ����ݣ������ж����з�Ӧ���ܳ������� �����ţ���
A��CH3COOH�� Na2CO3��NaHCO3��CH3COONa
B��CH3COOH��NaCN��CH3COONa��HCN
C��CO2��H2O��2C6H5 ONa��Na2CO3��2C6H5OH
������֪��ZnCl2��xH2O������ˮ������Ũ��ˮ��Һ�ʽ�ǿ���ԣ�SOCl2 (�Ȼ�����)����ˮ�������·�Ӧ��SOCl2��H2O=SO2��2HCl��ʵ��������ȡ��ˮ�Ȼ�п����ZnCl2��xH2O��SOCl2��ϼ��ȵķ������Իش�
SOCl2��������___________________________________��
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ���ˮ��ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
���ں����ܱ������У�������Ӧ3A(g)��B(g)![]() 2C(g)����H��Q kJ/mol���ش��������⣺
2C(g)����H��Q kJ/mol���ش��������⣺
��1��д���÷�Ӧƽ�ⳣ���ı���ʽ__________��
��2�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________(��
���)��
�� v(A)��3v(B) �ڻ��������ܶȱ��ֲ��䡡
����3 mol A���ĵ�ͬʱ��1 mol B���ɡ� ��C��Ũ�ȱ��ֲ���
��3������ʵ���õ����ݿ�֪���¶�Խ�߸÷�Ӧ�Ļ�ѧƽ�ⳣ��Խ����Q______0(����ڡ���С�ڡ�)��
��1�������£�ȡpH��2������ʹ�����Һ��100 mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ���________(�a����b��)���������м���Zn����Ϊm1��������Һ�м����Zn����Ϊm2����m1________m2(ѡ�����������������)��


��2����������pH��2������ʹ�����Һ�� 100 mL���ֱ��ˮϡ�ͺ�ʹpH��4���������м���ˮ�����ΪV1��������Һ�м����ˮ�����ΪV2���� V1______V2(���������������)��
�����£�Ũ�Ⱦ�Ϊ0.1 mol/L ������������Һ��pH���±���
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
��1����������Һ�е������ӣ����H+������ǿ����
��2�����ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01 mol/L �������������ʵ���Һ�У�������ǿ����_______ �����ţ� �� ������Һ�ֱ�ϡ��100���� pH�仯��С���� �����ţ� ��
A��HCN B��HClO C��C6H5OH D��CH3COOH E��H2CO3
��3�����ϱ����ݣ������ж����з�Ӧ���ܳ������� �����ţ���
A��CH3COOH�� Na2CO3��NaHCO3��CH3COONa
B��CH3COOH��NaCN��CH3COONa��HCN
C��CO2��H2O��2C6H5ONa��Na2CO3��2C6H5OH
������֪��ZnCl2��xH2O������ˮ������Ũ��ˮ��Һ�ʽ�ǿ���ԣ�SOCl2 (�Ȼ�����)����ˮ�������·�Ӧ��SOCl2��H2O=SO2��2HCl��ʵ��������ȡ��ˮ�Ȼ�п����ZnCl2��xH2O��SOCl2��ϼ��ȵķ������Իش�
SOCl2��������___________________________________��
